Es ist ein warmer Sommertag, du gönnst dir einen Eistee und gibst Eiswürfel hinein (Abb. 1). Natürlich schwimmen die Eiswürfel an der Oberfläche und gehen nicht unter. Das kennst du schon. So normal, wie du es vielleicht denkst, ist das gar nicht. Nach der Theorie zur Veränderung der Dichte von Stoffen im festen und flüssigen Zustand müsste der Eiswürfel eigentlich untergehen. Das macht er aber nicht.
Warum du dieses Phänomen überhaupt beobachten kannst und was genau an diesem Verhalten so besonders ist, erfährst du in diesem Artikel.
Anomalie – Abweichung vom Normalen
Eine Anomalie ist die Abweichung vom Normalen. Das Verhalten von Wasser im flüssigen und festen Zustand weicht von dem Verhalten anderer Stoffe ab. Du erwärmst beispielsweise Kerzenwachs, sodass dieses flüssig wird, und gibst ein Stück festes Kerzenwachs in dieses hinein (Abb. 2). Das feste Kerzenwachs geht unter und sinkt zu Boden. Wenn du den gleichen Stoff einmal in fest und einmal in flüssig vorliegen hast, ist es normal, dass der feste Stoff im flüssigen sinkt. Das Verhalten von Wasser weicht von dieser Normalität ab. Du hast Wasser im flüssigen Zustand und gibst dort Wasser im festen Zustand, also Eis, hinein. Das Eis schwimmt auf dem flüssigen Wasser.
Schwimmen und Sinken hängt von der Dichte ab
Der Stoff mit der geringeren Dichte schwimmt. Der Stoff mit der größeren Dichte sinkt. Festes Kerzenwachs hat eine höhere Dichte als flüssiges Kerzenwachs. So verhält es sich mit den meisten Stoffen. Je kälter die Temperatur ist, desto höher ist die Dichte. Bei einem Stoff im festen Zustand ist die Dichte größer als bei dem gleichen Stoff im flüssigen Zustand.
Beim Wasser ist es aber anders: Eis (festes Wasser) hat eine geringere Dichte als Wasser. Die Dichte von Eis liegt zwischen \(\ce{0,86 \frac{g}{cm^3}}\) und \(\ce{0,92 \frac{g}{cm^3}}\). In dem Diagramm von Abbildung 3 kannst du erkennen, dass die Dichte von Wasser bei \(\ce{0\,^{\circ}C}\) bereits knapp unter \(\ce{0,9985 \frac{g}{cm^3}}\) liegt. Die Dichte von Eis ist wesentlich geringer als die Dichte des flüssigen Wassers.
Zwischen \(\ce{0\,^{\circ}C}\) und \(\ce{4\,^{\circ}C}\) steigt die Dichte von Wasser an. Bei \(\ce{4\,^{\circ}C}\) hat Wasser die größte Dichte. Bei steigender Temperatur sinkt die Dichte von Wasser wieder.
Wichtig für die Umwelt
Die Dichteanomalie des Wassers ist wichtig für die Lebewesen im Wasser. Durch dieses Phänomen frieren Seen und Teiche nicht komplett zu, sodass die Fische und andere Lebewesen im unteren Bereich des Sees überwintern können. Wie du bereits erfahren hast, hat Wasser die größte Dichte bei \(\ce{4\,^{\circ}C}\). Der Stoff mit der größeren Dichte sinkt zu Boden.
In Seen hat das Wasser am Boden immer \(\ce{4\,^{\circ}C}\) (Abb. 4). Je wärmer das Wasser ist, desto geringer ist die Dichte. Je weiter du dich bis zur Wasseroberfläche bewegst, desto wärmer wird das Wasser. Wenn es Winter wird und die Temperaturen der Luft sinken, kühlt die Wassertemperatur an der Oberfläche des Sees ab. Das Wasser am Boden des Sees hat immer noch eine Temperatur von \(\ce{4\,^{\circ}C}\), weil es die höchste Dichte besitzt. Wenn sich an der Wasseroberfläche Eis bildet, sinkt dieses nicht zu Boden, sondern bleibt an der Oberfläche. Auf diese Wiese friert nicht der komplette See zu, sondern immer nur die obere Schicht. Die Fische halten sich im Winter am Boden des Sees auf.
Die Dichte von Eis hängt vom Kristallgitter ab
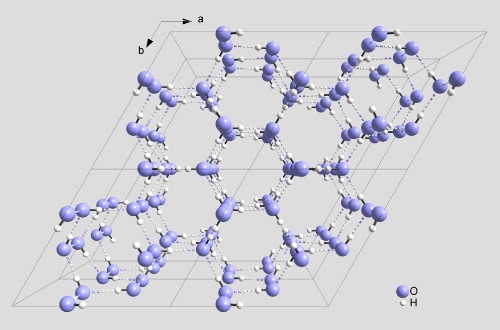
Wie aber lässt sich dieses Dichte-Phänomen von Wasser erklären? Zwischen den Wassermolekülen herrschen Wasserstoffbrücken. Diese führen dazu, dass Wasser im festen Zustand Kristallgitter aus Hexagonen bildet (Abb. 5). In dieser Anordnung sind die Moleküle an einem festen Platz. Diese Anordnung führt dazu, dass Eis eine vergleichsweise niedrige Dichte hat.
Im flüssigen Zustand von Wasser mischt sich die Struktur aus der Anordnung von Hexagonen und einem Chaos. Die Moleküle sind beweglich. Sie bilden Wasserstoffbrücken zu anderen Wasser-Molekülen. Dabei gibt es schnelle Übergänge, in denen Wasserstoffbrücken wieder zu anderen Molekülen gebildet werden. Bei \(\ce{4^{\circ}C}\) ist die Anordnung der Wasser-Moleküle am dichtesten. Mit steigender Temperatur nimmt die Geschwindigkeit der Wasser-Moleküle zu. Je schneller die Moleküle sich bewegen, desto mehr Platz nehmen sie ein. Über \(\ce{4^{\circ}C}\) vergrößert sich daher das Volumen des Wassers und die Dichte nimmt fortlaufend ab.
Im gasförmigen Zustand herrscht unter den Wasser-Molekülen die maximale Unordnung. Die Wasser-Moleküle bewegen sich so schnell, dass sie die Wasserstoffbrücken nicht mehr halten können. Die Moleküle verteilen sich weiter und nehmen mehr Platz ein. In diesem Zustand hat Wasser sein maximales Volumen und die geringste Dichte.
Zusammenfassung
Dichteanomalie bedeutet, dass sich die Dichte von Wasser anders verhält als sich die Dichte von Stoffen normalerweise verhält. Normal ist, je niedriger die Temperatur, desto größer ist die Dichte. Wasser hat die größte Dichte allerdings bei \(\ce{4\,^{\circ}C}\). Eis hat eine deutlich geringere Dichte als Wasser und schwimmt deshalb an der Wasseroberfläche. Die geringe Dichte kannst du mit der Kristallstruktur des Eises erklären, wobei die Wassermoleküle weiter voneinander entfernt sind als beim Wasser im flüssigen Zustand.
Aufgabe
Aufgabe
Im Chemieunterricht verwendet ihr sicherlich Thermometer, in denen sich der Alkohol Ethanol befindet (Abb. 7). Hast du ein Thermometer mit Ethanol, dann nimmt das Volumen des Ethanols mit steigender Temperatur zu. Das kannst du daran erkennen, dass die rote Flüssigkeit im Thermometer die Skala hochwandert.
Stelle dir vor, in dem Thermometer wäre kein Ethanol, sondern Wasser. Was würde passieren, wenn du das Thermometer mal in Eiswasser hältst, dann die Raumtemperatur misst und es mal in kochendes Wasser hältst?
Überlege dir, wieso wir im Labor kein wasser-basiertes Thermometer, sondern ein Ethanol-Thermometer verwenden. Notiere die Argumente, die für bzw. gegen den Einsatz eines Wasser-Thermometers bzw. Ethanol-Thermometers sprechen.