Aus deinem Alltag kennst Du Eis, Wasser und Wasserdampf. Für uns ist selbstverständlich, dass ein Eiswürfel bei Raumtemperatur schmilzt und sich Wasser bildet. Dieses Phänomen hast du bestimmt schon beobachtet, ebenso wie du beim Erhitzen von Wasser bis es kocht, die Bildung von Wasserdampf beobachten konntest. Vielleicht hast du an kalten Wintertagen auf Feldern oder Straßen Raureif (Abb. 1) gesehen. Hierbei handelt es sich stets um denselben Stoff, den wir als Wasser bezeichnen. Dennoch unterscheiden sich die Zustandsformen Eis, Wasser und Wasserdampf.
In diesem Artikel erfährst Du, wie sich Stoffe beim Erhitzen und Abkühlen verhalten, welche Aggregatzustände es gibt und wie diese mit den Stoffeigenschaften Schmelz- und Siedetemperatur zusammenhängen.
Aggregatzustände – Stoffe haben unterschiedliche Zustandsformen
Wie du weißt, kann Wasser in unterschiedlichen Zuständen vorliegen. Diese Zustandsformen sind fest (Eis), flüssig (Wasser) und gasförmig (Wasserdampf). Diese Zustandsformen werden in der Fachsprache als Aggregatzustände bezeichnet.
Ein fester Stoff, wie ein Eiswürfel, hat eine feste Form und ein festes Volumen. Auch flüssiges Wasser hat ein festes Volumen, es hat jedoch keine feste Form mehr. Daher passt sich die Form von flüssigem Wasser seiner Umgebung an. Ein gasförmiger Stoff hat ebenfalls keine feste Form, aber trotzdem ein festes Volumen. Dass gasförmige Stoffe ein festes Volumen haben, kannst du dir verdeutlichen, indem du dir einen Luftballon vorstellst, der mit Gas befüllt wird.
Schmelzen und Erstarren - Übergänge zwischen fest und flüssig
Der Aggregatzustand eines Stoffes ist abhängig von der Umgebungstemperatur. Mittels Erhitzens oder Abkühlen kannst du den Aggregatzustand eines Stoffes beeinflussen.
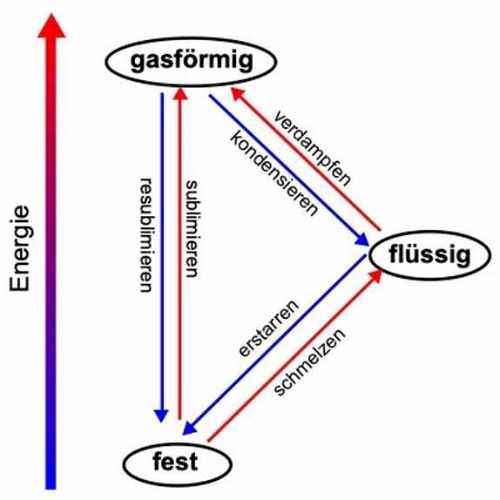
Dies kannst du dir gut verdeutlichen, indem du einen Eiswürfel aus dem Eisfach herausnimmst und ihn bei Raumtemperatur stehen lässt. Du kannst beobachten, wie der Eiswürfel flüssig wird. Dieser Übergang vom festen in den flüssigen Zustand wird als Schmelzen bezeichnet. Der umgekehrte Übergang findet beim Zubereiten von Eiswürfeln statt, wenn du flüssiges Wasser in den Eisschrank stellst. Der Übergang von flüssig zu fest wird als Erstarren bezeichnet.
Verdampfen und Kondensieren - Übergänge zwischen flüssig und gasförmig
Beim Kochen von Wasser kannst du weitere Übergänge beobachten. Wird Wasser ausreichend erhitzt, fängt es umgangssprachlich an zu kochen: Du erkennst dies anhand sich bildender Blasen. In diesen befindet sich gasförmiges Wasser, das an die Oberfläche steigt und in die Atmosphäre entweicht. Dieser Übergang vom flüssigen zum gasförmigen Aggregatzustand wird Verdampfen oder Sieden genannt. Trifft gasförmiges Wasser auf eine kalte Oberfläche, wie beispielsweise eine Fensterscheibe, schlägt es sich als Flüssigkeit nieder. Dieser Übergang vom gasförmigen zum flüssigen Zustand wird als Kondensieren bezeichnet.
Übrigens: Schon, wenn Du oberhalb es kochenden Wassers Dampfschwaden siehst, sind das kleine Wassertröpfchen, die sich bilden, weil das Wasser-Gas kondensiert. Diese Schwaden sind vergleichbar mit Nebel.
Sublimieren und Resublimieren - Übergänge zwischen fest und gasförmig
Unter bestimmten Bedingungen gehen manche Stoffe direkt vom festen in den gasförmigen Zustand über. Liegt Schnee über einen längeren Zeitraum kann trotz ständigem Frost beobachtet werden, dass die Menge an Schnee stetig kleiner wird. Schnee ist, wie Eis, gefrorenes Wasser und kann direkt vom festen in den gasförmigen Zustand übergehen, ohne vorher zu schmelzen. Dieser Übergang vom festen direkt zum gasförmigen Aggregatzustand wird Sublimieren genannt. Auch der umgekehrte Vorgang kann auftreten. Nach einem nächtlichen Frost kannst du am nächsten Morgen auf Feldern oder im Garten Raureif beobachten. Dabei schlägt sich der Wasserdampf aus der Luft als fester Reif nieder, was wieder nichts anderes ist als gefrorenes Wasser. Der Übergang vom gasförmigen zum festen Zustand wird Resublimieren genannt. Die Aggregatzustände und deren Übergänge kannst du dir in Abbildung 2 anschauen.
Nicht nur bei Wasser lässt sich der Aggregatzustand durch Erhitzen oder Abkühlen beeinflussen, auch die Zustände anderer Stoffe können so beeinflusst werden. In welchem Aggregatzustand sich ein Stoff befindet, hängt also von der Temperatur ab. Die Temperaturen, bei denen Stoffe in einen anderen Aggregatzustand übergehen, sind für jeden Stoff unterschiedlich. In Lehrbüchern findest du hierfür die sogenannten Schmelz- und Siedetemperaturen als Angabe.
Schmelztemperatur – Feste Stoffen können schmelzen
Dir ist bekannt, dass Eis bei \(\ce{0 °C}\) schmilzt, aber auch Kerzenwachs oder andere Feststoffe schmelzen bei einer gewissen Temperatur. Im folgenden Video kannst du den Temperaturverlauf beim Schmelzen von Kerzenwachs beobachten.
Wie du anhand des Videos beobachten konntest, steigt die Temperatur bis zu einem gewissen Punkt an und bleibt dann während des Schmelzvorganges unverändert. Erst wenn das Wachs vollständig geschmolzen ist, steigt die Temperatur weiter an. Dieses Phänomen kannst du auch bei beim Schmelzen von Eis oder anderen Feststoffen beobachten.
Die Temperatur, bei der ein fester Stoff durch Zufuhr von Wärme flüssig wird, ist die Schmelztemperatur. Im Umkehrschluss wird die Temperatur, bei der ein flüssiger Stoff durch Abkühlen wieder in den festen Zustand übergeht, als Erstarrungstemperatur bezeichnet. Die Schmelz- und Erstarrungstemperatur eines Reinstoffes sind identisch. Da bei Reinstoffen beide Temperaturen identisch sind, wird in vielen Lehrbüchern deshalb nur die Schmelztemperatur angegeben.
Siedetemperatur – auch Wasser kann ein Gas sein
Wird ein flüssiger Stoff erhitzt, erhöht sich seine Temperatur, bis sich im Inneren der Flüssigkeit Gasblasen bilden und die Flüssigkeit siedet. Die Temperatur, bei der ein Stoff siedet, wird Siedetemperatur genannt. Auch die Siedetemperatur eines Reinstoffes ändert sich während des Siedens nicht, diesen Vorgang kannst du dir für Wasser im folgenden Video (Abb. 4) ansehen.
Aus deinem Alltag weißt du, dass Wasser bei \(\ce{100 °C}\) kocht. Wenn du im Video zur Siedetemperatur genau hingesehen hast, konntest du beobachten, dass für die Stoffportion Wasser eine Siedetemperatur von \(\ce{98 °C}\) gemessen wurde. Diese Beobachtung hängt damit zusammen, dass die Siedetemperatur vom Umgebungsdruck abhängig ist. Bei normalem Luftdruck (\(\ce{pn}\) = \(\ce{1013 hPa}\)) würde Wasser bei \(\ce{100 °C}\) sieden, verändert sich jedoch der Luftdruck so verändert sich auch die Siedetemperatur. Verringert sich der Luftdruck, verringert sich auch die Siedetemperatur und umgekehrt.
Auch die Schmelztemperatur wird in geringem Maße vom Umgebungsdruck beeinflusst, allerdings so geringfügig, dass es für Betrachtungen mit normalen Luftdruckschwankungen keine Rolle spielt.
| Stoff | Schmelztemperatur | Siedetemperatur |
|---|---|---|
| Wasser | \(\ce{0 °C}\) | \(\ce{100 °C}\) |
| Kochsalz | \(\ce{800 °C}\) | \(\ce{1465 °C}\) |
| Eisen | \(\ce{1538 °C}\) | \(\ce{3000 °C}\) |
| Blei | \(\ce{327 °C}\) | \(\ce{1744 °C}\) |
Typische Temperaturangaben für Schmelz- und Siedetemperaturen in Lehrbüchern oder Tabellenwerken, wie du sie in Abb. 5 siehst, sind folglich immer auf den Normaldruck bei \(\ce{1013 hPa }\) bezogen.
Übrigens: Häufig wird beim Experimentieren auch vom Schmelz- oder Siedepunkt gesprochen. Schmelz- oder Siedepunkte sind allerdings immer auf die Temperaturen unter Normalbedingungen bezogen. Da im Alltag oder in der Schule von der Norm abweichende Bedingungen vorliegen, ist es vorzuziehen, von Schmelz- und Siedetemperaturen zu sprechen.
Zusammenfassung
Stoffe können in den Aggregatzuständen fest, flüssig und gasförmig auftreten. Durch Erhitzen und Abkühlen oder Druckveränderungen kann der Aggregatzustand eines Stoffes beeinflusst werden.
Die messbaren Schmelz- und Siedetemperaturen sind charakteristische Stoffeigenschaften, mithilfe derer du Stoffe identifizieren kannst. Während des Überganges eines Aggregatzustandes zu einem anderen verändert sich die gemessene Temperatur nicht.