Bei dem Begriff „Alkohol“ denkst du sicher als erstes an den Trinkalkohol, fachsprachlich auch Ethanol genannt, und damit auch an alkoholische Getränke wie Bier oder Wein. Wusstest du, dass Trinkalkohol nicht nur in alkoholischen Getränken enthalten ist, sondern auch in vielen Produkten des täglichen Bedarfs zu finden ist? Du findest Ethanol in vielen Kosmetik-Artikeln wie Rasierwasser oder Parfüm, in Reinigungsmitteln wie Glasreiniger, in Medikamenten (z. B. Iberogast, Sinupret-Tropfen, Franzbranntwein) aber auch in vielen Lebensmitteln und Süßigkeiten. In diesem Artikel erfährst du, welche besonderen Eigenschaften Ethanol hat und vor allem, warum wir Ethanol in so vielen Produkten finden.
Eigenschaften von Ethanol
Ethanol ist eine farblose, leicht brennbare Flüssigkeit mit einem charakteristischen Geruch. Ethanol hat eine Dichte von \(\ce{0,79\,g/cm^3}\) und eine Siedetemperatur von \(\ce{78\,°C}\). Ethanol löst sich sehr gut in Wasser, ist aber auch in vielen organischen Stoffen wie z. B. Benzin löslich.
Wie lässt sich die im Vergleich zu Ethan (Siedetemperatur: \(\ce{-89\,°C}\)) sehr hohe Siedetemperatur und das ungewöhnliche Lösungsverhalten von Ethanol erklären? Dazu müssen wir uns den Bau der Ethanol-Moleküle ansehen.
Das Ethanol-Molekül besteht aus einer unpolaren Ethyl-Gruppe und einer polaren OH-Gruppe (Abb. 1).
Löslichkeit
Zwischen der polaren OH-Gruppe des Ethanol-Moleküls und den Wasser-Molekülen können sich Wasserstoffbrücken ausbilden (Abb. 2). Dadurch löst sich Ethanol sehr gut in Wasser. Ethanol ist aber auch in lipophilen Lösungsmitteln wie z. B. Benzin gut löslich. Das liegt daran, dass sich zwischen der unpolaren Ethyl-Gruppe des Alkohol-Moleküls und den Kohlenwasserstoff-Ketten von Alkan-Molekülen London-Dispersions-Wechselwirkungen bilden (Abb. 2).
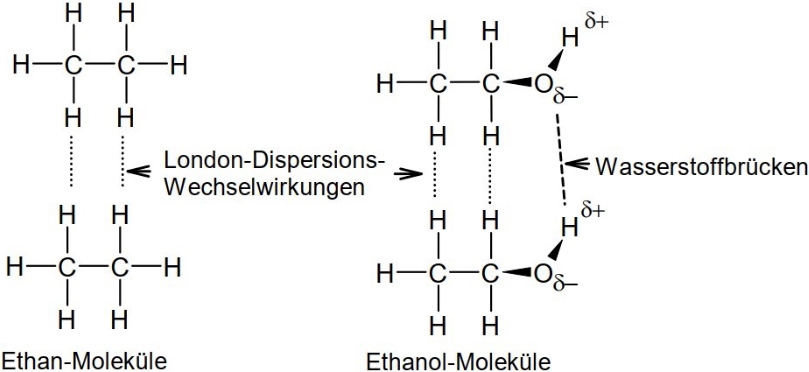
Siedetemperatur
Die polare OH-Gruppe ist auch für die – im Vergleich zu Ethan – hohe Siedetemperatur verantwortlich. Während zwischen den Ethan-Molekülen nur die relativ schwachen London-Dispersions-Wechselwirkungen wirken, können sich zwischen den Ethanol-Molekülen auch Wasserstoffbrücken ausbilden (Abb. 3). Wasserstoffbrücken sind wesentlich stärkere Anziehungskräfte als London-Dispersions-Wechselwirkungen. Deshalb benötigst du mehr Energie, um die Ethanol-Moleküle voneinander zu trennen als zum Aufbrechen der London-Dispersions-Wechselwirkungen zwischen zwei Ethan-Molekülen. Ethanol hat dadurch eine höhere Siedetemperatur als Ethan.
Brennbarkeit
Ethanol ist brennbar (Abb. 4), d. h. Ethanol reagiert mit Sauerstoff zu Kohlenstoffdioxid und Wasser. Bei der Verbrennung von Ethanol handelt es sich um eine exotherme Reaktion, d. h. es wird Energie freigesetzt.
$\ce{C_2H_5OH + 3O_2 -> 2 CO_2 + 3H_2O}$
Verwendung von Ethanol
Die besonderen Löse-Eigenschaften des Ethanols sind im Wesentlichen dafür verantwortlich, dass Ethanol in so vielen Alltagsprodukten enthalten ist. Ethanol ist ein gutes Lösemittel für Fette, Öle, Harze, Duft- und Farbstoffe. Mit Ethanol lassen sich z. B. Wirk-, Duft- und Farbstoffe aus Pflanzen herauslösen und so für medizinische und kosmetische Produkte nutzen. In Reinigern löst Ethanol fetthaltige Schmutzpartikel.
Ein weiterer Grund, warum Ethanol in kosmetischen Produkten wie Rasierwasser oder in Einreibemitteln wie Franzbranntwein zu finden ist, ist die kühlende Wirkung von Ethanol. Die kühlende Wirkung ist auf die im Vergleich zu Wasser niedrigere Siedetemperatur des Ethanols zurückzuführen. Ethanol verdunstet deshalb leichter als Wasser. Die dazu nötige Energie wird der Umgebung entzogen. Die Umgebung kühlt dabei ab.
Aufgrund seiner keimtötenden Wirkung wird Ethanol auch als Desinfektionsmitteln eingesetzt.
Ethanol ist brennbar und eignet sich deshalb auch als Treibstoff oder Treibstoffzusatz (Abb. 5). So bedeutet z. B. das in E10 neben Benzin 10 % Ethanol enthalten ist. Das Ethanol wird dabei aus nachwachsenden Rohstoffen, wie z. B. Mais gewonnen und soll so den Verbrauch fossiler Brennstoffe verringern.
Aber auch bei Lebensmitteln wird die Brennbarkeit genutzt: Getränke mit einem hohen Ethanolgehalt von mindestens 40 % sind brennbar. Diese Brennbarkeit wird teilweise bei Schnäpsen genutzt, da der brennende Schnaps nicht nur spektakulär wirkt (Abb. 4), sondern sich durch die Verbrennung auch den Geschmack des Schnapses ändern kann und beispielsweise der enthaltene Zucker karamellisiert.
Zusammenfassung
Ethanol ist ein sehr gutes Lösemittel sowohl für lipophile als auch für hydrophile Stoffe. Deshalb ist es in vielen Alltagsprodukten wie z. B. Reinigungsmittel, Kosmetikartikel oder medizinischen Produkten zu finden.