Im Magen eines jeden Menschen (Abb. 1) wird ätzende Salzsäure-Lösung produziert. Der pH-Wert beträgt (ohne Nahrung) 1,0. Durch die schnelle Erneuerung der Magenschleimhaut wird die Innenwand des Magens jedoch nicht angegriffen und verätzt. In den verschiedenen nachfolgenden Kompartimenten des Darms fehlt diese Schleimhaut allerdings. Angegriffen wird die Darmwand dennoch nicht, weil sich das Milieu durch Zugabe weiterer Stoffe schnell auf einen pH-Wert von ca. 8 ändert. Das Milieu im Darm wird also basisch. Dass es sich bei der Reaktion von Säuren und Basen um Vorgänge handelt, die vom Reaktionspartner abhängig sind, erfährst du in diesem Artikel genauer.
Säuren und Basen bilden in Wasser Ionen
Von vielen Salzen, wie Kochsalz, kennst du bereits, dass diese in Ionen zerfallen, wenn diese in Wasser gegeben werden. Säuren und Basen verhalten sich ähnlich und bilden in Wasser Ionen. Das kannst du an der erhöhten Leitfähigkeit von sauren und basischen Lösungen erkennen. Wie bei den Salzen hat man auch für die Säuren zunächst angenommen, dass diese in Wasser direkt zu Ionen zerfallen.
Nach Arrhenius zerfallen Säuren und Basen in Wasser
Laut Arrhenius, der eine frühe Säure-Base-Theorie entwickelte, wurden Säuren dabei als Stoffe definiert, die u.a. zu Protonen \(\ce{(H^+)}\) zerfallen, während Basen Stoffe sind, die in Lösung u.a. zu Hydroxid-Ionen \(\ce{(OH^-)}\)zerfallen.
Nach Brönsted sind Säuren Protonen-Donatoren und Basen Protonen-Akzeptoren
Die aktuellere Säure-Base-Theorie wurde, unabhängig voneinander, von zwei Professoren für Physikalische Chemie, dem Dänen Johannes Nicolaus Brönsted und dem Engländer Thomas Martin Lowry, entwickelt. Da die Arbeiten von Brönsted umfassender waren, wird zumeist sein Name mit diesem Konzept verbunden.
Nach dieser Theorie werden Säuren und Basen folgendermaßen definiert:
- Säuren sind Moleküle oder Ionen, die bei einer Reaktion Protonen an einen Reaktionspartner abgeben. Sie werden daher als Protonen-Donatoren (lat. donare = spenden) bezeichnet.
- Basen sind Moleküle, Atome oder Ionen, die bei einer Reaktion Protonen von einem Reaktionspartner aufnehmen. Sie werden daher als Protonen-Akzeptoren (lat. accipere = aufnehmen) bezeichnet.
Säuren und Basen benötigen immer einen Reaktionspartner
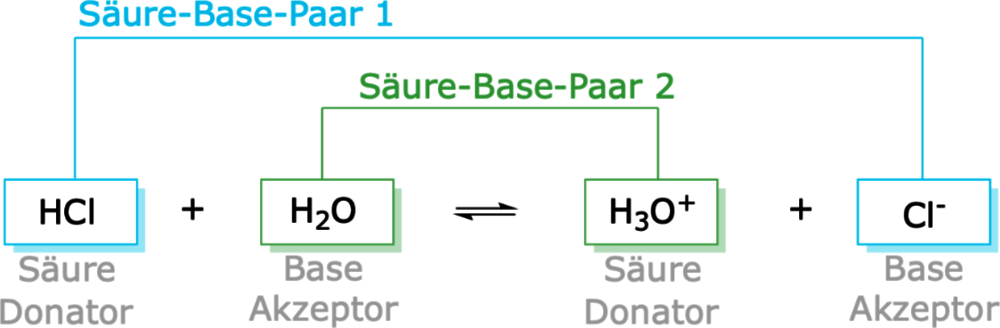
Die Definition nach Brönsted zeigt, dass die Stoffe, die als Säure oder Base wirken, immer einen weiteren Reaktionspartner benötigen. Das Lösen von Hydrogenchlorid \( \ce {(HCl)} \) in Wasser \( \ce {(H2O)} \) wird nach diesem Konzept nicht mehr als eine Dissoziation, also als ein Zerfall des \( \ce {HCl} \)-Moleküls in Wasser formuliert, sondern als eine Reaktion zwischen dem Protonen-Donator \( \ce {(HCl)} \) und dem Protonen-Akzeptor \( \ce {(H2O)} \) beschrieben (s. Abb. 2). An jeder Reaktion einer Säure ist immer auch eine Base beteiligt:
| \( \ce {HCl} \) | \( \ce + \) | \(\ce {H2O} \) | \(\ce{<=>>}\) | \( \ce {H3O^+} \) | \( \ce + \) | \( \ce {Cl^-} \) |
|---|---|---|---|---|---|---|
|
Säure |
Base Akzeptor |
Säure Donator |
Base Akzeptor |
Säureteilchen und Wasser-Moleküle reagieren zu Oxonium-Ionen, Baseteilchen und Wasser-Moleküle reagieren zu Hydroxid-Ionen
Da bei den Protonenübergängen Wasser-Moleküle mit Säureteilchen immer zu Oxonium-lonen $\ce{(H3O^+)}$ reagieren, ist eine saure Lösung durch einen Überschuss an Oxonium-lonen charakterisiert. Eine basische Lösung hingegen zeichnet sich entsprechend durch einen Überschuss an Hydroxid-Ionen aus $\ce{(OH^-)}$. Das liegt daran, dass jede Base in wässrigen Lösungen Protonen von Wasser-Molekülen aufnimmt. Negativ geladene Hydroxid-Ionen bleiben übrig.
Du weißt sicher bereits, dass Reaktionen reversibel ablaufen können. Chemische Reaktionen sind also umkehrbar. Betrachten wir nun die Rück-Reaktion in Richtung der Edukte (von rechts nach links), so erkennen wir ebenfalls wieder eine Säure-Base-Reaktion nach Brönsted: Das Oxonium-Ion gibt dabei als Brönsted-Säure ein Proton (Wasserstoff-Ion) an das Chlorid-Ion als Brönsted-Base ab (Abb. 2).
Was hat das aber nun mit dem Eingangsthema, unserem Verdauungssystem, zu tun?
Nachdem du jetzt weißt, dass Säuren und Basen flexibel miteinander reagieren können, wird auch klar, warum der saure Speisebrei im Darm keinen Schaden anrichtet und Verätzungen hervorruft. Dadurch, dass über Drüsen, wie die Bauchspeicheldrüse, verschiedene neue Stoffe zusammen mit dem Speisebrei in den Darm abgegeben werden, kann sich die Oxonium-Ionen-Konzentration schnell wieder reduzieren. Die Drüsensekrete wirken basisch und können damit gut Oxonium-Ionen, die sich im angesäuerten Speisebrei befinden, aufnehmen.
Protonenübergang zwischen Hydrogenchlorid und Wasser
In der folgenden Animation kannst du dir den Protonenübergang zwischen Hydrogenchlorid und Wasser ansehen. Die Pfeile in der Reaktionsgleichung zeigen dir an, welche Reaktionsrichtung gerade betrachtet wird:
Protonenübergang zwischen Ammoniak und Wasser
Beim Löse-Prozess von Ammoniak-Gas in Wasser ist das Ammoniak-Molekül mit dem freien Elektronenpaar der Protonen-Akzeptor und das Wassermolekül der Protonen-Donator. Auch hier handelt es sich um einer Säure-Base-Reaktion. Die Reaktionsgleichung sieht folgendermaßen aus:
| \( \ce {H2O} \) | \( \ce + \) | \(\ce {NH3} \) | \(\ce{<=>>}\) | \( \ce {NH4^+} \) | \( \ce + \) | \( \ce {OH^-} \) |
|---|---|---|---|---|---|---|
| Säure Donator |
Base Akzeptor |
Säure Donator |
Base Akzeptor |
Zusammenfassung
Die Reaktion einer Brönsted-Säure ist stets an die Anwesenheit einer Brönsted-Base geknüpft und umgekehrt. Ein Molekül oder Ion kann nur ein Proton abgeben, wenn ein Molekül, Atom oder Ion vorhanden ist, das dieses Proton dann aufnimmt. Am Beispiel des Wasser-Moleküls erkennst Du, dass es einmal (gegenüber einem Hydrogenchlorid-Molekül, Abb. 2) ein Proton aufnimmt und einmal (gegenüber einem Ammoniak-Molekül, Abb. 4) ein Proton abgibt.
Ein Atom, Ion oder Molekül ist daher nie absolut eine Brönsted-Säure oder –Base, sondern je nach Reaktionspartner. Es ist also sprachlich korrekter zu sagen, dass ein Atom, Ion oder Molekül in einer Reaktion als Brönsted-Säure oder Base wirkt.
Korrespondierende Säuren und Basen
Zu jeder Brönsted-Säure gibt es eine korrespondierende Brönsted-Base, nämlich genau die, die aus der Säure durch die Abgabe eines Protons entsteht. Umgekehrt gibt es zu jeder Brönsted-Base auch die korrespondierende Brönsted-Säure, nämlich genau diese, die aus der Base durch Aufnahme eines Protons gebildet wird. Diese Säure-Base-Kombinationen, die sich nur durch ein Proton mehr oder ein Proton weniger unterscheiden, werden als korrespondierende oder auch als konjugierte Säure-Base-Paare bezeichnet (Abb. 6).
Zusammenfassung
Durch Protonenabgabe entsteht aus einer Säure ($\ce{HA}$) deren korrespondierende Base ($\ce{A^-}$). Durch Protonen-Aufnahme entsteht aus einer Base ($\ce{B}$) deren korrespondierende Säure ($\ce{HB+}$).