Wasserstoffbrücken spielen eine bedeutende Rolle in der Natur. Sicherlich hast du schon einmal beobachtet, dass sich Wasser beim Gefrieren ausdehnt oder dass Wasserläufer auf der Wasseroberfläche laufen können. Diese Phänomene lassen sich auf die Wasserstoffbrücken zurückführen. Wasserstoffbrücken sind die stärksten zwischenmolekularen Wechselwirkungen.
Wann bilden sich Wasserstoffbrücken?
Damit sich Wasserstoffbrücken bilden können, müssen zwei Voraussetzungen erfüllt sein:
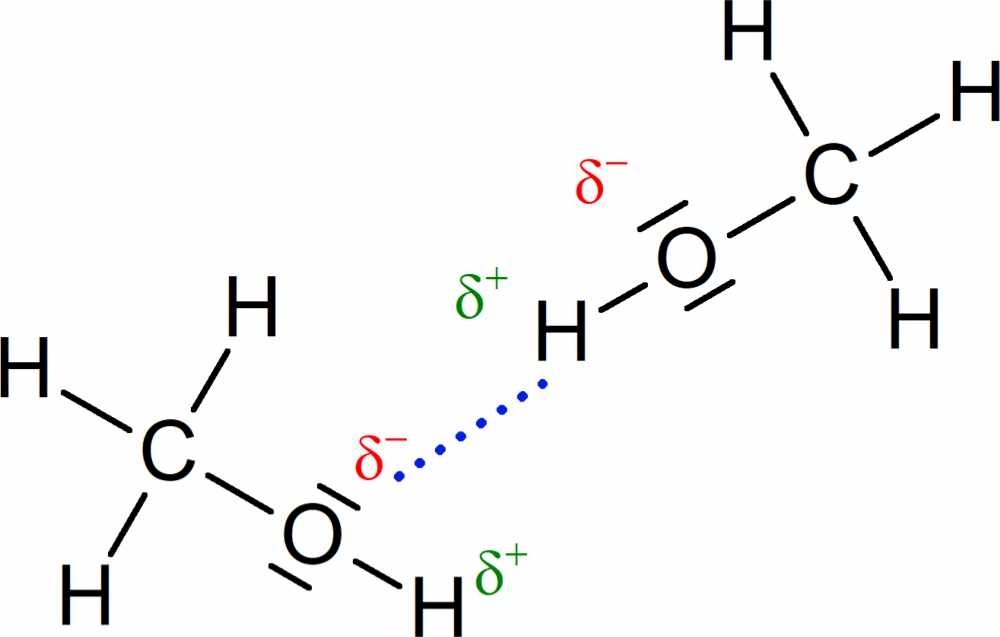
- Es muss ein Molekül vorliegen, in dem ein oder mehrere Wasserstoff-Atome an ein stark elektronegatives Atom (z. B. Sauerstoff, Stickstoff oder Fluor) gebunden sind. Die Atombindung in einem solchen Molekül ist stark polarisiert. Das liegt daran, dass der Kern des elektronegativeren Atoms (z. B. Sauerstoff) die Elektronen der kovalenten Bindung stärker anziehen kann, sodass am Wasserstoff-Atom ein Elektronenmangel entsteht. Auf diese Weise entsteht am Wasserstoff-Atom eine positive Teilladung. Am elektronegativeren Atom (z. B. Sauerstoff) herrscht ein Elektronenüberschuss und somit eine negative Teilladung.
- Zusätzlich müssen elektronegative Atome (z.B. Sauerstoff, Stickstoff oder Fluor) vorliegen, die (mindestens) ein freies Elektronenpaar besitzen.
Die partiell positiv geladenen Wasserstoff-Atome \(\ce{(\delta^+)}\) des einen Moleküls und die freien Elektronenpaare des elektronegativen Atoms des anderen Moleküls, welche partiell negativ geladen sind \(\ce{(\delta^-)}\), ziehen sich aufgrund ihrer entgegengesetzten Ladung an. Es bilden sich Wasserstoffbrückenbindungen aus. In Abb. 1 siehst du dies am Beispiel von zwei Methanol-Molekülen.
Wasserstoffbrücken, die zwischen zwei Molekülen auftreten, werden intermolekulare Wasserstoffbrücken genannt. In der Animation (Abb. 2) siehst du, wie sich solche intermolekulare Wasserstoffbrücken zwischen Wasser-Molekülen bilden.
Abb. 2 Animation Wasserstoffbrücken
Hingegen wird von intramolekularen Wasserstoffbrücken gesprochen, wenn sich Wasserstoffbrücken innerhalb eines sehr großen Moleküls (z. B. innerhalb eines Proteins oder im Cellulose-Molekül) bilden (Abb. 3).
Sind Wasserstoffbrücken echte Bindungen?
Häufig kannst du fälschlicherweise von „Wasserstoffbrückenbindungen“ lesen. Das lässt vermuten, dass es sich bei Wasserstoffbrücken um echte Bindungen handelt. Im klassischen Sinne sind Wasserstoffbrücken aber keine “echten” Bindungen, wie die z.B. kovalente Bindungen, ionische Bindungen oder die Metallbindungen. Durch Wasserstoffbrücken nähern sich die Moleküle zwar stark an und werden über die „Brücke“ miteinander verbunden, im Vergleich zu den anderen Bindungsarten sind sie jedoch schwach und lassen sich leicht trennen. Daher werden sie zu den zwischenmolekularen Kräften bzw. Wechselwirkungen gezählt und stellen keine echte chemische Bindung dar.
Welche Auswirkungen haben Wasserstoffbrücken auf die Eigenschaften und Strukturen von Stoffen?
Siede- und Schmelztemperatur
Als stärkste zwischenmolekulare Kräfte haben die Wasserstoffbrücken großen Einfluss auf die Eigenschaften von Stoffen. Sowohl die Schmelztemperatur als auch die Siedetemperatur sind höher bei Stoffen, die Wasserstoffbrücken ausbilden können.
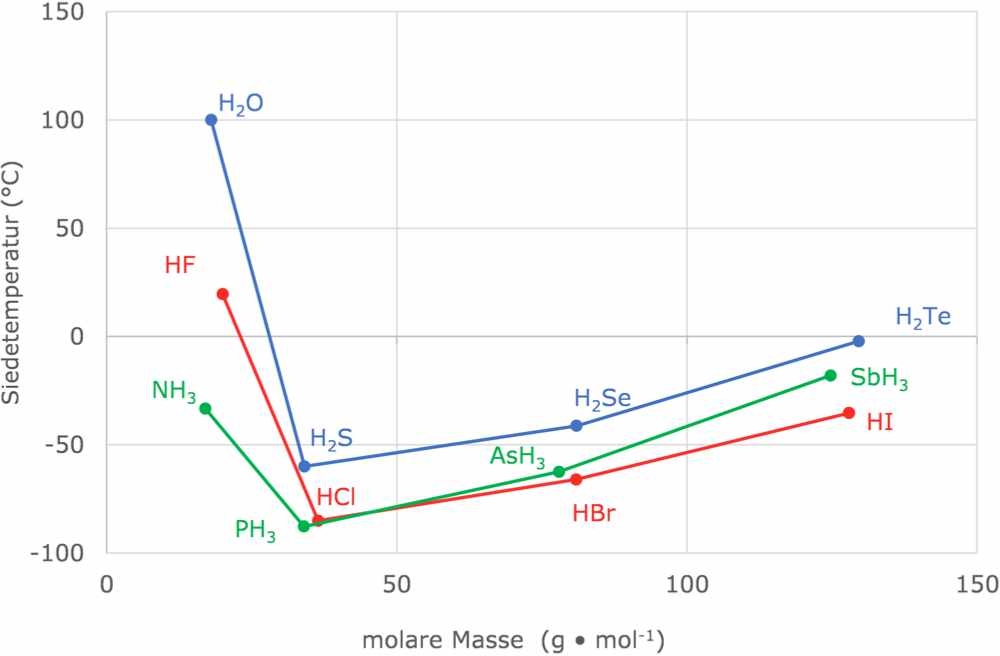
In Abb. 4 sind die Siedetemperaturen verschiedener Wasserstoffverbindungen einiger Hauptgruppenelemente dargestellt. Am Beispiel Wasser wird ersichtlich, dass Wasser einen deutlich höheren Siedepunkt aufweist als die anderen Wasserstoffverbindungen der Elemente der sechsten Hauptgruppe. Dies liegt daran, dass Wasser-Moleküle untereinander Wasserstoffbrücken ausbilden (siehe Abb. 2 Animation Wasserstoffbrücken). Wird Wasser zum Sieden gebracht, wird daher mehr Energie benötigt bis die Siedetemperatur erreicht ist, weil zusätzlich Energie aufgewendet werden muss, um die Wasserstoffbrücken aufzulösen. Daher liegt die Siedetemperatur höher.
Räumliche Strukturen
Eine wichtige Rolle spielen Wasserstoffbrücken auch bei bestimmten Biomolekülen, wie den Proteinen. Die Ausbildung von Wasserstoffbrücken hat hier einen Einfluss auf die räumliche Struktur des Moleküls. Bei der Sekundärstruktur, wie dem \(\ce\beta\)-Faltblatt (Abb. 5) oder den Helices (Abb. 6), bilden sich Wasserstoffbrücken zwischen den Peptid-Bindungen der Polypeptid-Hauptkette. Die Tertiärstruktur wird neben anderen Wechselwirkungen und Bindungen, wie ionischen Wechselwirkungen und Disulfid-Brücken, ebenfalls durch Wasserstoffbrücken geformt. Hier bilden sich Wasserstoffbrücken zwischen den Resten, den Seitenketten der Aminosäuren, aus.
Zusammenfassung
Wasserstoffbrücken sind die stärksten zwischenmolekularen Wechselwirkungen. Sie können sich ausbilden, wenn Wasserstoff-Atome mit positiven Teilladungen und sehr elektronegative Atome mit freien Elektronenpaaren (wie z.B. Sauerstoff oder Fluor) vorhanden sind. Für uns sind Wasserstoffbrücken deswegen wichtig und interessant, weil sie Auswirkungen auf die Eigenschaften (z.B. die Siedetemperatur) und die Struktur von Stoffen (z.B. bei Proteinen) haben.