Ein Bild kann uns viele Informationen liefern. Das Bild der Holzklötze (Abb. 1.1) zeigt uns zum Beispiel die Anzahl und die Anordnung der Holzklötze. Allerdings ist in dem Bild nicht zu sehen, wie hoch sie sind. Sind sie alle gleich hoch oder nicht? In einem dreidimensionalen Modell können diese Informationen hingegen dargestellt werden (Abb. 1.2).
Genauso wie ein Bild, liefert die modellhafte Darstellung eines Moleküls in der Valenzstrichformel nur eingeschränkt Informationen. Sie enthalten beispielsweise keine Informationen über den räumlichen Bau des Moleküls. Schauen wir uns mal ein Molekül aus drei Atomen an. Es gibt die Möglichkeit, dass es linear oder gewinkelt gebaut ist (Abb. 2). Doch warum ist das überhaupt wichtig? Viele Eigenschaften eines Stoffes werden direkt durch den räumlichen Bau der Moleküle beeinflusst. Deshalb lernst du in diesem Artikel, wie du die Molekülgeometrie anhand der Valenzstrichformel bestimmen kannst.
Elektronenpaar-Abstoßungs-Modell (EPA-Modell)
In Molekülen werden Atome durch bindende Elektronenpaare gebunden. Da diese Elektronenpaare aus negativ geladenen Elektronen bestehen, stoßen sich diese gegenseitig ab. Das heißt, die Elektronenpaarbindungen werden so angeordnet, dass sie möglichst weit voneinander entfernt sind. In diesem Modell wird dabei nicht zwischen Einfach- und Mehrfachbindungen unterschieden. Die Elektronen einer Elektronenpaarbindung werden immer von zwei Atomkernen angezogen. Das sorgt dafür, dass sich diese in der Regel zwischen den beiden Atomkernen liegen. Dabei ist es egal, ob es sich um zwei, vier oder sechs Elektronen handelt.
Schauen wir uns ein Molekül aus drei Atomen an: das Kohlenstoffdioxid-Molekül (Abb. 3.1). Das Kohlenstoff-Atom in der Mitte nennen wir Zentral-Atom. An dieses sind zwei Sauerstoff-Atome mit je einer Doppelbindung gebunden. Das Zentral-Atom hat also zwei Bindungspartner. Die Elektronenpaarbindungen stoßen sich gegenseitig ab. Der größte Abstand wird erreicht, wenn die beiden Bindungspartner gegenüber voneinander an das Zentral-Atom gebunden sind. Der Winkel zwischen den Bindungspartnern beträgt somit 180° (Abb. 3.2). Das Molekül ist also linear.
Schauen wir uns als nächstes das Methanal-Molekül an (Abb. 4.1). Dieses Molekül hat ein Kohlenstoff-Atom als Zentral-Atom, an das zwei Wasserstoff-Atome mit je einer Einfachbindung und ein Sauerstoff-Atom mit einer Doppelbindung gebunden sind. Das Zentral-Atom hat also drei Bindungspartner Auch hier stoßen sich die Elektronenpaarbindungen wieder gegenseitig ab. Der größtmögliche Abstand wird erreicht, wenn die Bindungspartner ein ebenes Dreieck bilden (Abb. 4.2). Die Struktur nennt man trigonal planar (trigonal = dreieckig, planar = eben). Der Winkel zwischen den Bindungen ist je 120° groß.
Als Letztes schauen wir uns noch ein Molekül mit noch einem Atom mehr an: das Methan-Molekül (Abb. 5.1). Es hat ein Kohlenstoff-Atom als Zentral-Atom, an das vier Wasserstoff-Atome mit je einer Einfachbindung gebunden sind. Das Zentral-Atom hat also vier Bindungspartner. Die Elektronenpaarbindungen stoßen sich wieder gegenseitig ab. Der größtmögliche Abstand entsteht in einem sogenannten Tetraeder (Abb. 5.2). Der Winkel zwischen allen Bindungen liegt jeweils bei 109,5°.
Einfluss nichtbindender Elektronenpaare auf den räumlichen Bau
Es gibt auch Moleküle die neben bindenden Elektronenpaaren auch nichtbindende haben. Diese stoßen sich genauso von anderen Elektronenpaaren ab, wie bindenden. Die nichtbindenden Elektronenpaare beeinflussen den räumlichen Bau somit auch. Schauen wir uns dazu das Wasser-Molekül an (Abb. 6.1). Das Zentral-Atom hat zwei Bindungspartner, aber auch zwei nichtbindende Elektronenpaare. Insgesamt sind also vier sich gegenseitig abstoßende Elektronenpaare am Zentral-Atom. Bei vier sich gegenseitig abstoßenden Elektronenpaaren ergibt sich eine tetraedrische Elektronengeometrie (Abb. 6.2). Für die Molekülgeometrie werden aber nur die am Zentral-Atom gebundene Atome betrachtet. Wir müssen uns aus dem Tetraeder also zwei Ecken wegdenken. Es ergibt sich eine gewinkelte Struktur. Der Winkel zwischen den beiden bindenden Elektronenpaaren liegt aber nicht bei 109,5° wie in einem Tetraeder, sondern bei 104,5°. Das liegt daran, dass die bindenden Elektronenpaare jeweils von den beiden positiv geladenen Atomkernen des Wasserstoff-Atoms und des Sauerstoff-Atoms angezogen werden. Die nichtbindenden Elektronenpaare werden hingegen nur von einem positiv geladenen Atomkern, nämlich von dem des Sauerstoff-Atoms, angezogen. Daher beanspruchen nichtbindende Elektronenpaare mehr Raum, als bindende. Die bindenden Elektronenpaare im Wasser-Molekül werden dadurch etwas zusammengedrückt und dadurch der Winkel dazwischen etwas kleiner.
Regeln zur Bestimmung des räumlichen Baus
Ganz egal, wie viele Elektronenpaare ein Molekül hat, es geht immer darum, dass diese einen möglichst großen Abstand zueinander haben. Damit du den räumlichen Bau, also die Molekülgeometrie, bestimmen kannst, ist es sinnvoll nach den folgenden Regeln vorzugehen:
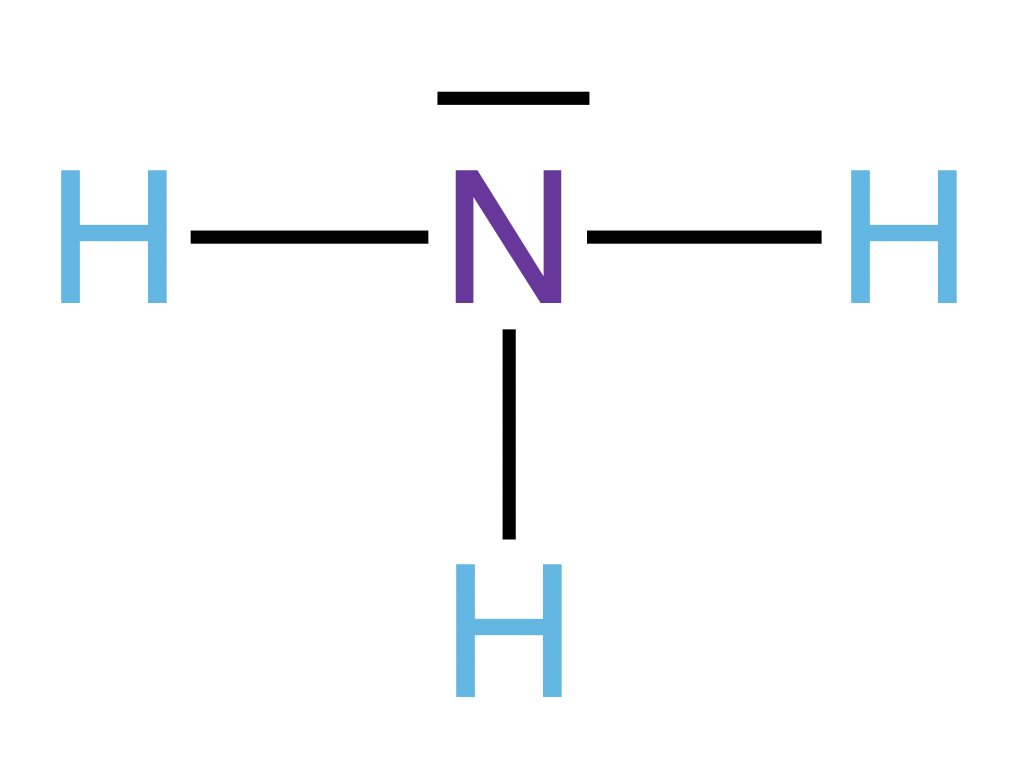
| Regeln | Beispiel: Stickstofftrihydrid \(\rm{NH_3}\) | ||||||||
| 1. Stelle die Valenzstrichformel des Moleküls auf. |
|
||||||||
| 2. Bestimme die Anzahl der Bindungspartner am Zentral-Atom und addiere sie mit der Anzahl der nichtbindenden Elektronenpaare am Zentral-Atom (\(\Rightarrow\) Summe) |
|
||||||||
|
3. Bestimme die Elektronengeometrie anhand der Summe aus Schritt 2:
|
Summe = 4 \(\Rightarrow\) tetraedrische Elektronengeometrie |
||||||||
|
4. Für die räumliche Struktur werden nur die Atome eines Moleküls und nicht die nichtbindenden Elektronenpaare betrachtet. Daher musst du die nichtbindenden Elektronenpaare in der Elektronengeometrie "wegdenken", um die Molekülgeometrie zu bestimmen. |
Das nichtbindende Elektronenpaar müssen wir aus der Elektronengeometrie "wegdenken". Dadurch entsteht eine Pyramide mit einer dreieckigen Grundfläche. Diese Molekülgeometrie nennen wir trigonal pyramidal. |
Übersicht der verschiedenen räumlichen Strukturen
In der folgenden Übersicht kannst du dir die verschiedenen Elektronen- und Molekülgeometrien anschauen.
| Anzahl Bindungs-partner | Anzahl NEP | Summe | Elektronengeometrie | Molekülgeometrie |
| 2 | 0 | 2 |
|
|
| 3 | 0 | 3 |
|
|
| 2 | 1 | 3 |
|
|
| 1 | 2 | 3 |
|
|
| 4 | 0 | 4 |
|
|
| 3 | 1 | 4 |
|
|
| 2 | 2 | 4 |
|
|
| 1 | 3 | 4 |
|
|
Hier kannst du dir die verschiedenen Elektronen- und Molekülgeometrien dreidimensional anschauen. Alle dort angegebenen Bindungswinkel beziehen sich auf die idealen Winkelgrößen, wobei zum Beispiel nicht berücksichtigt wird, dass nichtbindende Elektronenpaare mehr Raum einnehmen als Elektronenpaarbindungen. Es sind außerdem noch weitere Molekülgeometrien, welche hier aber weggelassen wurden, da es sich bei mehr als vier Bindungen nicht mehr nur um Elektronenpaarbindungen handelt.
Zusammenfassung
Das Elektronenpaar-Abstoßungs-Modell (EPA-Modell) dient dazu, die Molekülgeometrie eines Moleküls zu bestimmen. Es basiert darauf, dass sich Elektronenpaare gegenseitig abstoßen.
Um den räumlichen Bau zu bestimmen, gehst du nach folgendem Schema vor:
- Valenzstrichformel aufstellen.
- Anzahl der Bindungspartner und nichtbindenden Elektronenpaare am Zentral-Atom bestimmen.
- Elektronengeometrie anhand von Schritt 2 bestimmen.
- Molekülgeometrie bestimmen, indem nichtbindende Elektronenpaare bei der Elektronengeometrie "weggedacht" werden.