Die Organische Chemie ist überall. In diesem Artikel wirst du erkennen, dass du organische Stoffe, wie Alkohole, Ether, Aldehyde und Ketone sowie Ester viel besser kennst, als du vielleicht denkst. Eines haben alle Stoffe, mit denen sich die Organische Chemie beschäftigt gemeinsam: Sie bestehen alle aus Kohlenwasserstoff-Verbindungen. Unzählige Stoffe unseres Lebens haben die Gemeinsamkeit, dass sie aus Kohlenstoff-Atomen aufgebaut sind und dennoch unterscheiden sie sich teilweise stark in ihren Eigenschaften. In diesem Teilgebiet der Chemie erfährst du viele interessante Phänomene deiner Umwelt mithilfe der Organischen Chemie.
Alles wird aus Kohlenwasserstoffen gemacht
Kohlenwasserstoffe begleiten dich in deinem Leben überall. Dein Körper basiert auf Kohlenwasserstoffen, genauso wie alle Pflanzen und Lebewesen. Dir begegnen Kohlenwasserstoffe aber in noch vielen Bereichen mehr, was wir dir in dem Teilgebiet der Organischen Chemie zeigen.
Eines der Treibhausgase, das zum Klimawandel beiträgt, ist Methan. Methan entsteht bei der Verdauung und wird als Gas abgesondert. Kühe produzieren bei der Verdauung viel Methan-Gas, welches sie auspupsen (Abb. 1). Hoher Fleischkonsum von Menschen bedeutet, dass es viele Kühe geben muss, die Methan absondern. Die hohe Methanmenge ist wiederum problematisch für das Klima, da dadurch sehr viel Treibhausgas in die Umwelt gelangt und der Treibhauseffekt verstärkt wird.
Propan ist ein weiteres Beispiel für einen Kohlenwasserstoff. Wenn du einen Gasgrill zuhause hast, dann kannst du dir das Propan dafür in einer Gasflasche im Baumarkt kaufen. Vielleicht bist du auch gerne unterwegs und gehst Campen. Dann ist es auch praktisch, dass du Propan in kleinen Flaschen für deinen Campingkocher mitnehmen kannst. Propan ist auch ein Bestandteil des Autogases, welches als Kraftstoff für bestimmte Fahrzeuge verwendet wird. Vielleicht hast du schon mal die Aufschrift gesehen: Ich fahre mit Erdgas.
Die Welt der Kohlenwasserstoffe ist noch um einiges vielseitiger, wie wir dir in den Themenbereichen der Kohlenwasserstoffe zeigen.
Isomere sind gleich und dennoch unterschiedlich
Das Wort Isomerie kommt aus dem Altgriechischem und bedeutet gleiches Stück. Isomere sind nämlich gleich, aber dennoch unterschiedlich. Es gibt verschiedene Arten der Isomerie. Beispielsweise können sich Moleküle wie Bild und Spiegelbild verhalten. Stehst du vor einem Spiegel, sind du und dein Spiegelbild auch gleich. Vielleicht hattest du schon mal das Gefühl, auf einem Foto seltsam auszusehen. Das kommt daher, dass du dich im Spiegel immer nur spiegelverkehrt siehst. Es gibt auch Kohlenwasserstoffe, die von der Anzahl der Atome und bezüglich der Verknüpfungen zwischen den Atomen gleich sind, aber sich wie Bild und Spiegelbild verhalten.
Ein anderes Beispiel für Isomere zeigen wir dir am Butan, welches ebenfalls, wie das Propan, ein Bestandteil des Autogases ist. Was ist der Unterschied zwischen \( \ce{C4H10} \) und \( \ce{C4H10} \)? Auf den ersten Blick ist in der Molekülformel kein Unterschied erkennbar. Trotzdem haben die verschiedenen Isomere des Butans unterschiedliche Eigenschaften, auch wenn sie die gleiche Anzahl an Kohlenstoff- und Wasserstoffatomen haben. Die Kohlenstoff- (und Wasserstoff-)Atome können verschieden verknüpft werden, sodass einmal eine Kohlenstoff-Kette entsteht und einmal ein verzweigtes Molekül (Abb. 2). Damit wir die Isomere des Butans unterscheiden können, wenn wir darüber sprechen, nennen wir das Butan als Kette n-Butan und das Butan mit der Abzweigung Isobutan oder auch 2-Methylpropan.
Welche unterschiedlichen Isomere gebildet werden können und wie wir über eine systematische Namensgebung die Isomere unterscheiden können, erklären wir dir in dem Teilbereich der Isomere.
Reaktionsmechanismen – der Blick auf die Teilchenebene
Stelle dir vor, du möchtest eine Kette verschenken. Mit einer bestimmten Technik verbindest du Kettenteil für Kettenteil, bis deine Kette ausreichend lang ist. Du schaust dir die Kette an und möchtest ihr Aussehen gerne verändern. Dafür nimmst du wieder mit einer bestimmten Technik das ein oder andere Teilstück aus deiner Kette heraus und ersetzt die Lücken durch andere Teilstücke. Es kann aber auch sein, dass du die Kette am Ende doch nicht mehr haben möchtest. Mit wieder einer bestimmten Technik trennst du Kettenteil für Kettenteil voneinander.
Ähnlich laufen die Reaktionsmechanismen in der Chemie ab. Mit ihnen betrachten wir auf der Teilchenebene, wie unterschiedliche Verbindungen von Kohlenwasserstoffgruppen aufgebaut, verändert und abgebaut werden. Es gibt unterschiedliche Möglichkeiten, Kohlenwasserstoffketten und –netzwerke zu bilden. Wenn einzelne Kohlenwasserstoffe (Monomere) miteinander zu Ketten oder Netzwerken (Polymere) verbunden werden, nennen wir die Reaktion Addition. Genauso ist es, wenn Kohlenwasserstoffe oder einzelne Atome zu den Kohlenwasserstoffketten hinzugefügt werden. Werden einzelne Atome oder Gruppen einer Kohlenwasserstoffkette herausgenommen und durch andere Atome oder Kohlenwasserstoffe ersetzt, nennen wir die Reaktion Substitution. Wenn die Kohlenwasserstoffgruppen gespalten werden, nennen wir die Reaktion Eliminierung. Was genau bei den unterschiedlichen Reaktionsmechanismen passiert und warum diese Mechanismen wichtig für unseren Alltag sind, erklären wir dir in dem Themenbereich zu den Reaktionsmechanismen.
Alkohole sind nicht nur das, was du denkst
Bei dem Wort Alkohol denkst du sicherlich direkt an die alkoholischen Getränke, die ab einem bestimmten Alter im Supermarkt käuflich erhältlich sind. Alkohole sind aber nicht nur Wein und Bier. Tatsächlich ist nur Ethanol derjenige Alkohol, der in Maßen verzehrt werden kann. Alle anderen Alkohole, z.B. Methanol in gepanschten Getränken, können auch schon in geringeren Mengen gesundheitliche Schäden anrichten. Ethanol entsteht beispielsweise bei Gärungsprozessen, das haben sich auch schon die Menschen im Mittelalter zu Nutzen gemacht. Ethanol wird auch in Medikamenten, kosmetischen Produkten und Desinfektionsmitteln eingesetzt. Vielleicht kennst du auch die Kamine, die ganz ohne Feuerholz funktionieren. Diese Kamine werden mit Ethanol gefüllt und geben beim Entzünden des Ethanols eine schöne Flamme ab (Abb. 3).
Welche Stoffe noch alle zu den Alkoholen gehören und welche Eigenschaften sie haben, erfährst du im Themenbereich Alkohole.
Ether machen uns müde
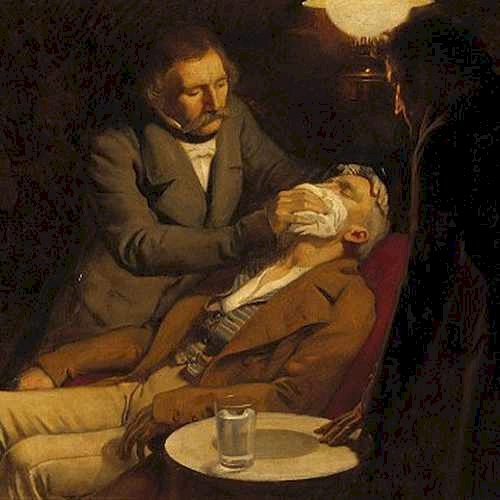
Wenn Operationen stattfinden, sehen wir es als selbstverständlich, dass es die Möglichkeit gibt, eine Narkose zu bekommen. Mithilfe der Narkose bekommt die zu operierende Person nichts mit und hat auch keine Schmerzen von der Operation. Das war aber nicht immer so. Dank der Ether wurde 1846 der Grundstein der Entwicklung der Narkose gelegt. William Morton, ein US-amerikanischer Zahnarzt, hat nämlich seine Patienten die Dämpfe eines Ethers einatmen lassen (Abb. 4). Darauf schlief der Patient ein und William Morton begann mit seiner Operation, die er öffentlich durchführte.
Die narkotisierende Wirkung ist eine Eigenschaft der Ether. Sie bestehen aus Kohlenwasserstoff-Ketten, in denen zusätzlich Sauerstoff-Atome gebunden sind. Durch ihre Struktur sind sie hervorragende Lösungsmittel für wasserunlösliche Verbindungen. Was die Ether noch alles können, erklären wir dir in dem Themenbereich der Ether.
Aldehyde und Ketone mögen unsere Sinne
Du kennst Aldehyde und Ketone besser, als du denkst. Sie sind nämlich Duftstoffe unserer Natur und Umwelt. Mandeln und beispielsweise daraus hergestelltes Marzipan haben einen lieblichen Duft und so schmecken sie auch (Abb. 5). Verantwortlich für diesen typischen Geruch und Geschmack ist der Benzaldehyd. Aldehyde und Ketone sind Kohlenwasserstoff-Moleküle, in denen ein Sauerstoff-Atom mit einer Doppelbindung an ein Kohlenstoff-Atom gebunden ist. Wir nennen sie auch dehydrierten Alkohol, weil durch das Entziehen eines Wasserstoff-Atoms die Doppelbindung zwischen dem Sauerstoff- und dem Kohlenstoff-Atom entsteht. Das Benzaldehyd-Molekül ist auch so aufgebaut, wobei die Kohlenstoff-Atome als Ring angeordnet sind. Dadurch, dass wir wissen, welches Molekül für den Mandelduft und –geschmack in der Natur verantwortlich ist, kann mithilfe technischer Verfahren dieses Aroma auch künstlich hergestellt werden. Im Supermarkt in der Backabteilung kannst du das Benzaldehyd kaufen. Es ist dort als Bittermandelaroma in kleinen Fläschchen abgefüllt. Ähnlich ist es mit dem Aroma Vanillin.
Formaldehyd ist ein weiteres Beispiel für einen Aldehyd, das dir schon mal im Alltag begegnet ist. Es ist nämlich in Früchten, wie Äpfeln, enthalten und wirkt generell konservierend gegen z. B. Schimmelpilze. Vielleicht hast du im Naturwissenschaftsunterricht auch schon mal eingelegte Frösche oder ähnliches gesehen. Diese Frösche können schon vor langer Zeit in den Gläsern eingelegt worden sein und du würdest es ihnen nicht ansehen. Das liegt an dem Formaldehyd, durch das bereits tote Lebewesen oder Teile davon für lange Zeit haltbar gemacht werden.
Wo dir die Aldehyde und Ketone noch im Alltag begegnen, wie sie hergestellt werden und wofür sie noch alles eingesetzt werden, erfährst du im Themenbereich Aldehyde und Ketone.
Ester sind so vielseitig in unserem Alltag
Hast du schon einmal was von Estern gehört? Schau mal auf die Etiketten einiger Textilien. Bestimmt findest du irgendwo, dass ein Kleidungsstück aus Polyester hergestellt wurde. Dank technischer Verfahren ist es möglich, aus Alkoholen und Säuren Ester zu bilden. Weiterhin ist es möglich, aus den einzelnen Molekülen (Monomere) lange Ketten (Polymere) zu bilden. Mehrere Ester miteinander verbunden nennen wir dann Polyester. Bei Flaschen und Verpackungen aus PET handelt es sich ebenfalls um (Poly)Ester.
Ester findest du noch in vielen weiteren Bereichen. Die Ester-Moleküle entstehen aus einem Alkohol und einer Säure. Ester können beispielsweise aus Essigsäure (Abb. 6) und Ethanol hergestellt werden. Daraus ergibt sich der Essigsäure-Ethyl-Ester.
In Früchten, wie Erdbeeren, Äpfeln und Orangen, sind ebenfalls Ester enthalten. Sie sind geruchs- und geschmacksgebende Komponenten. Fruchtaromaten sind oft Ester und können auch mithilfe technischer Verfahren synthetisiert werden, d. h. künstlich hergestellt werden. Wenn du also den Duft oder Geschmack einer frischen Orange wahrnimmst, muss nicht unbedingt eine frische Orange vorhanden sein.
Wie du siehst, gibt es Ester in vielen Bereichen deines Lebens. Tauche mit uns ein in die Welt der Ester. Wir zeigen dir noch viele Phänomene der Ester mehr und erklären dir die Eigenschaften mithilfe der Strukturen ihrer Moleküle.
Aromaten haben ein intensives Aroma
Die Bezeichnung der Aromaten kommt nicht zufällig von Aroma. Viele Aromaten haben einen aromatischen Geruch, den wir entweder mögen oder nicht mögen. Ein gutes Beispiel ist der Geruch des Benzins an der Tankstelle. Manche Menschen mögen den Geruch und andere wiederum nicht. Der Geruch des Benzins kommt unter anderem von dem Aromaten Benzol. Benzol ist ein typisches Beispiel für ein Aromaten. Benzol-Moleküle bestehen aus einem Kohlenwasserstoff-Ring mit Doppelbindungen (Abb. 7). Diese Molekülstruktur ist typisch für die Aromaten. Den Benzolring findest du in vielen weiteren Verbindungen der organischen Chemie wieder. Er ist beispielsweise auch Bestandteil des Polystyrols, was du sicherlich unter dem Namen Styropor kennst.
Erfahre noch viele weitere interessante Einsatzmöglichkeiten der Aromaten und welche Funktionen sie in den uns bekannten Stoffen des Alltags haben. Aber Vorsicht: nicht alle Stoffe mit Aroma sind auch Aromaten!