Hinweise zum Experiment
Damit in Chemie bzw. beim Experimentieren keine Unfälle passieren, musst du auf die Sicherheit achten. Die Sicherheit ist immer wichtig, wenn du in einem Fachraum oder Labor bist. Bitte beachte bei allen Experimenten die Hinweise zur Sicherheit im Labor. Die Durchführung des Experiments erfordert eine Gefährdungsbeurteilung durch die Lehrkraft.
Material
- Mörser mit Pistill
- Messer
- Spatellöffel
- Schraubdeckelglas
- Trichter
- Filterpapier
- Erlenmeyerkolben
- Seesand
- Zitronen- oder Orangenschalen (alternativ: Zimtstangen, Gewürznelken, Kümmel)
Chemikalien
- Ethanol
Edukte
| Stoffname | Summenformel | Gefahrenhinweise |
|---|---|---|
| Ethanol | \(\ce{C2H5OH}\) |
H225: Flüssigkeit und Dampf leicht entzündbar.
H319: Verursacht schwere Augenreizung.
P210: Von Hitze, heißen Oberflächen, Funken, offenen Flammen sowie anderen Zündquellen fernhalten. Nicht rauchen.
P240: Behälter und zu befüllende Anlage erden.
P305+P351+P338: BEI KONTAKT MIT DEN AUGEN: Einige Minuten lang behutsam mit Wasser spülen. Eventuell vorhandene Kontaktlinsen nach Möglichkeit entfernen. Weiter spülen.
P403+P233: An einem gut belüfteten Ort aufbewahren. Behälter dicht verschlossen halten.
|
Versuchsaufbau/Durchführung
- Zerreibe die kleingeschnittene Schale einer Zitrone oder Orange (alternativ: Zimtstange, Gewürznelken, Kümmel) mit etwas Seesand in einem Mörser. Gib das zerriebene Material in das Schraubdeckelglas und überschichte das zerriebene Material mit Ethanol, so dass das zerriebene Pflanzenmaterial von der Flüssigkeit überdeckt ist. Verschließe das Glas und lasse das Glas mehrere Tage im Dunkeln stehen.
- Filtriere anschließend den Feststoff ab und prüfe den Geruch des Filtrats.
- Gib 3 Tropfen des Filtrats auf ein Filterpapier und prüfe nach dem Verdunsten des Ethanols noch einmal den Geruch.
Tipps und Tricks
Für dieses Experiment ist Spiritus aufgrund des Eigengeruchs als Ersatz für Ethanol nicht geeignet.
Hinweise zur Entsorgung
Ethanol: flüssige organische Abfälle, halogenfrei; Feststoffe: in den Restmüll
Aufgabe
Aufgabe
Führe das Experiment durch und notiere deine Beobachtung.
Aufgabe
Aufgabe
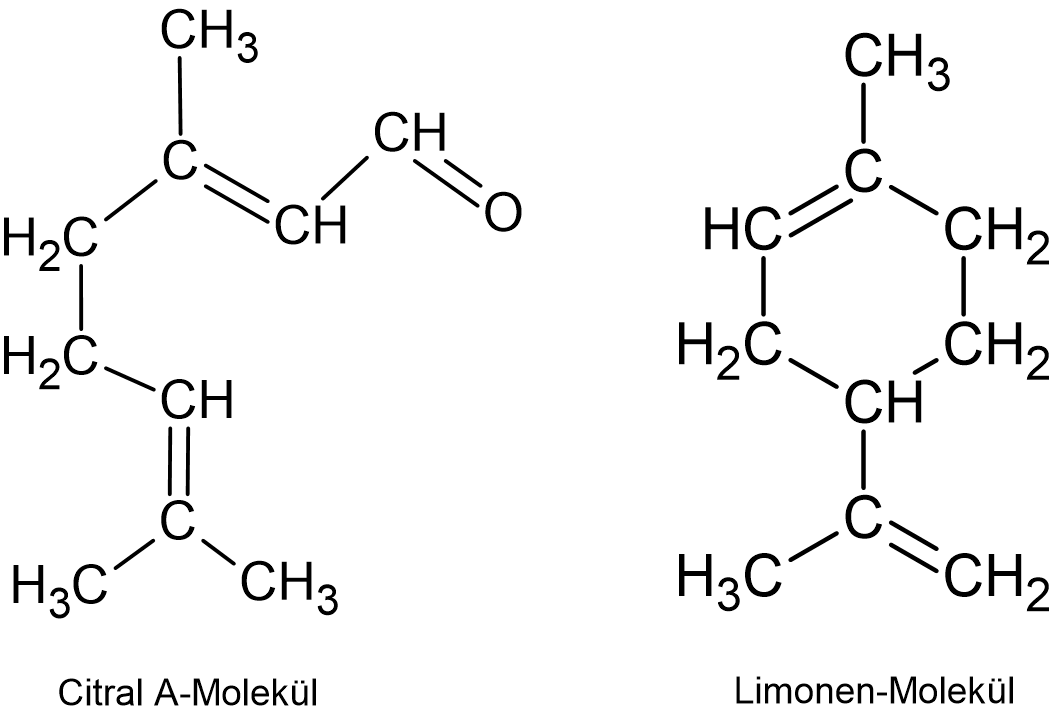
Ätherisches Zitronenöl besteht aus mehreren verschiedenen organischen Stoffen. Hauptbestandteil ist das Limonen. Für den charakteristischen Geruch der Zitrone ist Citral A verantwortlich. Erkläre, warum sich diese beiden Stoffe sehr gut mit Ethanol aus der Zitronenschale herauslösen lassen.