Sicher hast du schon davon gehört, dass es beim Genuss von illegal gebranntem Schnaps zu Vergiftungen kommen kann. Verursacher der Vergiftungen ist Methanol. In geringen Dosen führt Methanol zur Erblindung, in höheren Dosen zum Tod. Doch Methanol ist auch eine wichtige Grundchemikalie der chemischen Industrie.
Eigenschaften von Methanol
Methanol ist eine farblose, leicht brennbare Flüssigkeit mit einem alkoholischen Geruch. Methanol hat eine Dichte von 0,79 \(\frac {\ce g} {\ce {cm^3}}\) und verdunstet sehr leicht. Die Siedetemperatur von Methanol ist geringer als die Siedetemperatur von Ethanol und beträgt 65 °C. Methanol löst sich sehr gut in Wasser und löst sich dagegen kaum in Ölen oder Fetten.
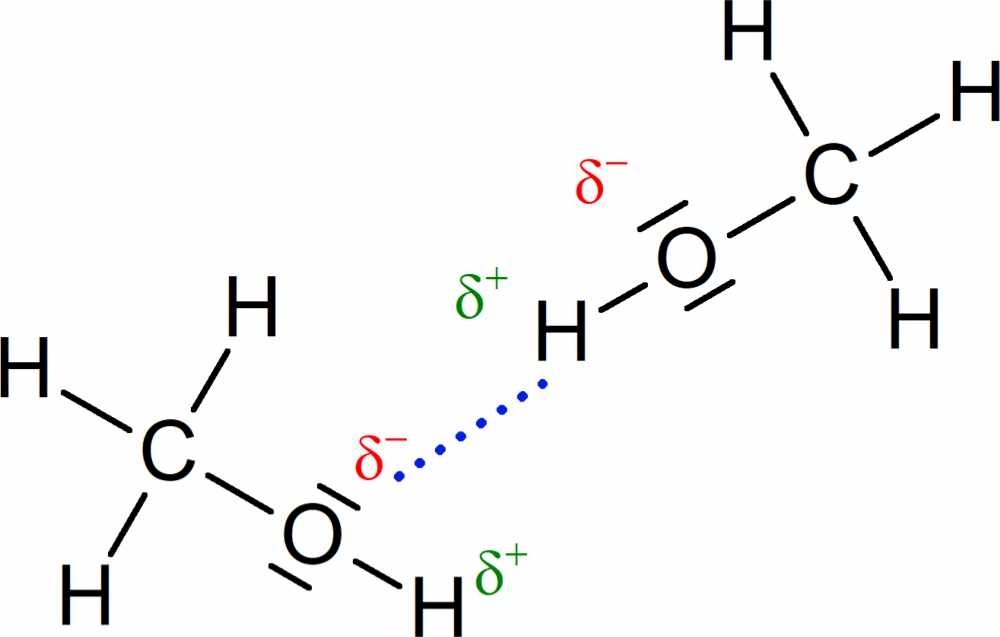
Das Methanol-Molekül besteht aus einer unpolaren Methyl-Gruppe und einer polaren Hydroxy-Gruppe. Die Hydroxy-Gruppe ist im Wesentlichen für die Stoffeigenschaften (Löslichkeit, Siedetemperatur) des Methanols verantwortlich (Abb. 1). So können sich zwischen den OH-Gruppen verschiedener Methanol-Moleküle bzw. zwischen den OH-Gruppen der Methanol-Moleküle und den Wasser-Molekülen Wasserstoffbrücken ausbilden, die für die relativ hohe Siedetemperatur bzw. die Löslichkeit des Stoffes verantwortlich sind.
Vorkommen
Reines Methanol kommt in der Natur nur sehr selten vor. So enthalten einige Pflanzen wie z. B. Baumwollpflanzen (Abb. 2) und einige Gräser in geringen Mengen Methanol. In vielen Früchten und holzigen Pflanzen sind allerdings Verbindungen wie z. B. Methylester, Alkaloide, Lignin zu finden, aus denen Methanol durch enzymatische Spaltung freigesetzt werden kann. Deswegen entsteht bei der alkoholischen Gärung Pektin haltiger Früchte wie z. B. Äpfel oder Trauben in sehr geringen Mengen Methanol. Um sich vor Fressfeinden zu schützen, können mache Pflanzen wie z. B. Gräser Pektin enzymatisch spalten und dadurch Methanol freisetzen. Auf diese Weise gelangt Methanol-Dampf in die Atmosphäre.
Giftigkeit von Methanol
Methanol selbst ist nur gering giftig. Es sind die Abbauprodukte des Methanols, die für die stark giftige Wirkung verantwortlich sind. So wird Methanol im menschlichen Körper zu Formaldehyd oxidiert (Abb. 3). Aus dem Formaldehyd (Methanal) entsteht in einem weiteren Stoffwechselschritt Ameisensäure, die sich im menschlichen Körper anreichert. Sowohl Formaldehyd als auch Ameisensäure schädigen das Gehirn, die Sehnerven, Leber und Nieren. Die Ameisensäure führt zu einer Azidose (Übersäuerung) des Blutes und blockiert die Zellatmung. Dadurch kann kein Stoffwechsel mehr stattfinden. Dies führt letztlich zum Tod durch Atem- und Herzstillstand.
Verwendung von Methanol
Methanol gehört mit zu den meistproduzierten organischen Chemikalien und wird vielfältig genutzt. Methanol ist für die chemische Industrie ein wichtiger Ausgangsstoff für die Herstellung von Chemikalien wie z. B. Formaldehyd, Essigsäure, Methylamid oder Methylmethacrylat. Diese Stoffe wiederum sind Ausgangsprodukt für die Herstellung von Kunststoffen für die Textil- und Verpackungsindustrie, Klebstoffen, Lösungsmitteln, Windeln und vieles mehr.
Die chemische Industrie nutzt Methanol auch als Lösemittel für Farbstoffe, Lacke, Harze und anorganische Salze. Außerdem dient Methanol als Frostschutz- und Reinigungsmittel und wird als Weichmacher eingesetzt. In der Erdölindustrie wird Methanol als Extraktionsmittel eingesetzt.
Methanol kann auf vielfältige Weise energetisch genutzt werden. Es kann direkt als Treibstoff eingesetzt oder dem Benzin zugemischt werden und ist als Kraftstoff sowohl für Autos als auch für Schiffe oder Lokomotiven geeignet. Da Methanol biologisch abbaubar ist, lässt es sich im Vergleich zu Benzin oder Diesel gefahrlos transportieren. Lediglich beim Tanken von methanolhaltigem Treibstoff ist Vorsicht geboten, denn Methanol verdampft leicht und ist giftig.
Methanol kann ebenfalls als Brennstoff in der Brennstoffzellentechnik eingesetzt werden. Zum einen lässt sich aus Methanol Wasserstoff für die Wasserstoff-Brennstoffzelle herstellen, zum anderen kann es direkt als Brennstoff in der Direkt-Methanol-Brennstoffzelle genutzt werden (Abb. 4). Dazu wird ein Methanol-Wasser-Gemisch zur Anode der Brennstoffzelle geleitet. Auf der Anodenoberfläche ist ein Katalysator aufgebracht. Trifft das Methanol-Wasser-Gemisch auf den Katalysator reagieren die Wasser- und Methanol-Moleküle zu Kohlenstoffdioxid-Molekülen, Protonen und Elektronen. Die Protonen wandern durch die Polymer-Membran zur Kathode. Die Elektronen wandern über einen elektrischen Verbraucher ebenfalls zur Kathode. An der Kathode reagieren die Protonen und Elektronen mit den zugeführten Sauerstoff-Molekülen der Luft zu Wasser-Molekülen.
Methanol – Hoffnungsträger für die Energiewende
Methanol wird großtechnisch aus Synthesegas hergestellt (siehe Reaktionsgleichung). Synthesegas wird in Europa im Wesentlichen aus Erdgas gewonnen und besteht aus Wasserstoff, Kohlenstoffmonoxid (\(\ce{CO}\)) und Kohlenstoffdioxid (\(\ce{CO2}\)).
\( \ce {CO + 2\ H_2} \rightleftharpoons \ce{CH_3OH}\); \(\ce \Delta {\ce{H(300 K)}} = -90,8 \frac {\ce{kJ}} {\ce{mol}}\)
\( \ce {CO_2 + 3\ H_2} \rightleftharpoons \ce {CH_3OH \ + \ H_2O}\); \(\Delta {\ce {H(300 K)}}=-49,6 \frac {\ce{kJ}} {\ce{mol}}\)
In den letzten Jahren wird Methanol vermehrt mithilfe erneuerbarer Energien wie Wind- oder Solarenergie hergestellt (Abb. 5). Die erneuerbaren Energien werden dazu genutzt, aus Wasser elektrolytisch Wasserstoff herzustellen. Kohlendioxid wird aus Biogas-, Vergärungsanlagen oder industriellen Rauch- und Abgasen gewonnen. Das so hergestellte Methanol ist deshalb klimaneutral, da kein zusätzliches Kohlenstoffdioxid durch den Herstellungsprozess in die Atmosphäre gelangt. Deshalb bezeichnet man das so hergestellte Methanol als “grünes Methanol“. „Grünes Methanol“ ist umweltfreundlich und kann als Energieträger zur Speicherung von regenerativ erzeugtem Strom eingesetzt werden. Es kann, wie konventionell hergestelltes Methanol (auch „graues Methanol“ genannt), als Treibstoff und als wichtiger Rohstoff für viele chemische Produkte genutzt werden. Deshalb ist „grünes Methanol“ ein großer Hoffnungsträger für die Transformation der chemischen Industrie hin zu einer nachhaltigen und klimaneutralen Industrie.
Zusammenfassung
Methanol ist ein wichtiges Ausgangsprodukt für die chemische Industrie. Als Energieträger gewinnt Methanol eine zunehmende Bedeutung für die Energiewende.