Wenn wir etwas Salz in Wasser geben, so ist das Salz nach einiger Zeit nicht mehr sichtbar. Wir sagen dann: „das Salz hat sich im Wasser gelöst”. Dass das Salz nicht verschwunden ist, erkennen wir daran, dass die Lösung jetzt salzig schmeckt.
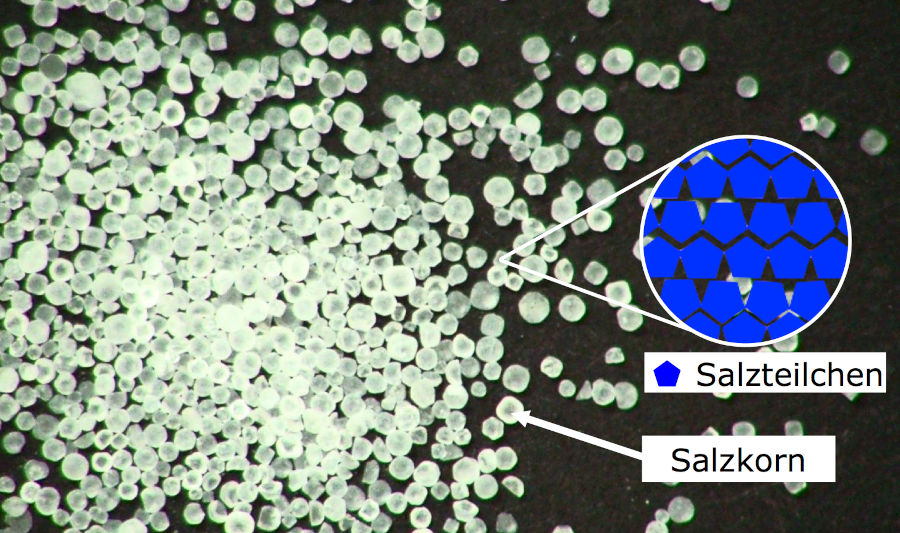
Das Teilchenmodell kann hier eine gute Erklärung liefern. Der Stoff Salz besteht aus einzelnen Salz-Teilchen. Jedes einzelne Salzkorn besteht dabei aus unzählig vielen Salz-Teilchen (Abb. 1), die durch Anziehungskräfte zusammengehalten werden. Da sehr viele Salzteilchen dicht und geordnet zusammen sind, können wir dies auch als Verbund von Salzteilchen bezeichnen.
Wasser ist bei Raumtemperatur flüssig. Das Wasser besteht aus einzelnen Wasser-Teilchen, die sich ungeordnet bewegen und dicht aneinander sind. Durch die Bewegung der Wasser-Teilchen kommt es dazu, dass einige Wasserteilchen auf den Verbund von Salzteilchen stoßen. Nicht nur zwischen gleichen Teilchen wirken Anziehungskräfte, auch zwischen Salz-Teilchen und Wasser-Teilchen wirken Anziehungskräfte. Die Wasser-Teilchen trennen einzelne Salz-Teilchen von den anderen Salz-Teilchen ab und die Wasser-Teilchen bilden eine Hülle um die Salz-Teilchen. Nach und nach werden so alle Salzteilchen voneinander getrennt. Ein einzelnes Salz-Teilchen ist so klein, dass wir es nicht mehr mit unserem Auge wahrnehmen können. Daher sieht es für uns so aus, als wäre das Salz verschwunden. Stattdessen sind jedoch die Salz-Teilchen zwischen den Wasser-Teilchen verteilt und von einer Hülle aus Wasser-Teilchen umschlossen.
In der folgenden Abbildung 2 siehst du, wie du dir das Lösen von einem Salz in Wasser auf der Teilchenebene vorstellen kannst:
- Einige Wasser-Teilchen (hier grün dargestellt) stoßen auf den Verbund von Salz-Teilchen (hier lila dargestellt).
- Die Wasser-Teilchen trennen einzelne Salz-Teilchen aus dem Salz-Teilchen-Verbund ab.
- Nach und nach werden alle Salz-Teilchen durch die Wasser-Teilchen aus dem Salz-Teilchen-Verbund gelöst.
- Die Wasser-Teilchen bilden eine Hülle um die Salz-Teilchen. Einzelne Salz-Teilchen sind sehr klein, daher können wir sie nicht sehen.
Der Löseprozess in kaltem und heißem Wasser
Du hast vielleicht schon einmal beobachtet, dass sich Salz oder Zucker in heißem Wasser schneller löst als im kalten Wasser. Dies liegt daran, dass sich durch die höhere Energie der Teilchen die Teilchen schneller bewegen. Dadurch treffen schneller und häufiger Wasser-Teilchen auf den Verbund von Salz-Teilchen und können einzelne Salz-Teilchen herauslösen. Übrigens können wir auch ohne Erwärmen die Lösungsgeschwindigkeit erhöhen – wenn wir das Gemisch umrühren, erhöhen wir auch die Zusammenstöße von Wasser-Teilchen auf Salz-Teilchen, so dass der Verbund schneller aufgelöst wird.
Kann man beliebig viel Feststoff in einer Flüssigkeit lösen?
Vielleicht hast du schon einmal mehr Kakaopulver in Milch geschüttet als in der Anleitung stand. Wenn zu viel Kakaopulver in der Milch ist, löst sich nicht mehr das gesamte Pulver auf. Das Gleiche gilt auch, wenn du andere lösliche Feststoffe in eine Flüssigkeit gibst, zum Beispiel Kochsalz in Wasser. Ab einer bestimmten Menge Salz löst sich das Salz nicht mehr auf, sondern setzt sich am Boden ab. Eine solche Lösung wird als gesättigt bezeichnet.
Mit dem Teilchenmodell können wir uns das so erklären: In einer gesättigten Lösung sind sehr viele Salz-Teilchen verteilt. Deshalb treffen die Salz-Teilchen auch immer wieder auf andere Salz-Teilchen. Die Anziehungskräfte zwischen den Salz-Teilchen können bewirken, dass die Salz-Teilchen wieder einen Verbund bilden. Zur gleichen Zeit werden immer genauso viele Salz-Teilchen aus dem Teilchenverbund gelöst, wie neue Teilchenverbunde aus einzelnen Salz-Teilchen entstehen. Wie viel von dem Stoff gelöst werden kann, hängt von den Teilchen des Stoffes und der Temperatur des Stoffes und des Lösemittels ab.
Was passiert beim Abkühlen?
Wie viel Salz pro \(\ce{100 ml}\) löslich sind, ist von der Temperatur abhängig. Oft gilt, dass sich mehr Feststoff löst, je höher die Temperatur des Lösemittels ist. Umgekehrt gilt für diese Feststoffe aber auch, dass eine Abkühlung des Gemisches bewirkt, dass sich weniger Feststoff in dem Lösemittel löst. Schauen wir uns hierfür mal das Beispiel eines Salz-Wasser-Gemisches an:
Ein \(\ce{90 °C}\) warmes Salz-Wasser-Gemisch ist sehr energiereich, daher bewegen sich die Teilchen sehr schnell. Die Anziehungskräfte zwischen den Teilchen können durch die schnelle Bewegung der Teilchen überwunden werden. Kühlen wir das Gemisch ab (Abb. 3), wird den Teilchen Energie entzogen. Die Teilchen bewegen sich nun langsamer als vorher. Treffen nun zwei Salz-Teilchen aufeinander, bleiben sie zusammen. Die Energie reicht nicht mehr aus, um die beiden Salz-Teilchen auseinander zu reißen. Es entsteht ein Verbund aus Salz-Teilchen, der durch weitere Salz-Teilchen noch größer werden kann. Wenn der Verbund groß genug ist, können wir den Verbund als Salzkörnchen wahrnehmen.
- Beim Abkühlen wird dem System Energie entzogen. Dadurch bewegen sich die Teilchen langsamer.
- Da sich die Teilchen langsamer bewegen, können die Wechselwirkungen zwischen den Salz-Teilchen besser wirken. Die Salz-Teilchen ziehen sich an und es entsteht ein Verbund aus Salz-Teilchen.
- Wenn sich genug Salz-Teilchen gegenseitig angezogen haben und einen Verbund gebildet haben, ist der Verbund so groß, dass wir ihn als Salzkörnchen wahrnehmen können. Salz fällt aus und sinkt auf den Boden des Gefäßes.
Zusammenfassung
Salze und andere Stoffe verschwinden nicht, wenn die Stoffe in Wasser gelöst werden. Stattdessen werden die Teilchen des Stoffes aus dem Teilchen-Verbund gerissen und von Wasser-Teilchen umgeben. Dadurch, dass die Teilchen des Stoffes, wie z.B. Kochsalz-Teilchen, nicht mehr im Verbund vorliegen, können wir sie nicht mehr sehen. Wie viel Stoff in Wasser gelöst werden kann, hängt von dem Stoff und der Temperatur ab. Die meisten Stoffe lösen sich bei hoher Temperatur besser. Wenn die maximale Menge erreicht wurde, ist die Lösung gesättigt und der Rest setzt sich als Bodensatz ab.