Hinweise zum Experiment
Damit in Chemie bzw. beim Experimentieren keine Unfälle passieren, musst du auf die Sicherheit achten. Die Sicherheit ist immer wichtig, wenn du in einem Fachraum oder Labor bist. Bitte beachte bei allen Experimenten die Hinweise zur Sicherheit im Labor. Die Durchführung des Experiments erfordert eine Gefährdungsbeurteilung durch die Lehrkraft.
Material
- hohe Glasschale
- Zylinder
- Teelicht
Chemikalien
- Wasser (neutrales Leitungswasser)
- Bromthymolblau
- Sauerstoff
Edukte
| Stoffname | Summenformel | Gefahrenhinweise |
|---|---|---|
| Wasser | \(\ce {H2O} \) |
Kein gefährlicher Stoff nach GHS.
Kein gefährlicher Stoff nach GHS.
|
| Sauerstoff | \(\ce {O_2} \) |
H270: Kann Brand verursachen oder verstärken; Oxidationsmittel.
H280: Enthält Gas unter Druck; kann bei Erwärmung explodieren.
P220: Von Kleidung und anderen brennbaren Materialien fernhalten.
P244: Ventile und Ausrüstungsteile öl- und fettfrei halten.
P370+P376: Bei Brand: Undichtigkeit beseitigen, wenn gefahrlos möglich.
P403: An einem gut belüfteten Ort aufbewahren.
|
| Paraffinwachs, Granulat | $\ce{C{_n}H_{\rm2n+2}}$ |
Kein gefährlicher Stoff nach GHS.
Kein gefährlicher Stoff nach GHS.
|
Produkte
| Stoffname | Summenformel | Gefahrenhinweise |
|---|---|---|
| Kohlenstoffdioxid (als Reaktionsprodukt) | \(\ce {CO_2} \) |
Kein gefährlicher Stoff nach GHS.
P403: An einem gut belüfteten Ort aufbewahren.
|
| Wasser | \(\ce {H2O} \) |
Kein gefährlicher Stoff nach GHS.
Kein gefährlicher Stoff nach GHS.
|
Versuchsaufbau/Durchführung
- Befülle die Glasschale etwa halbvoll mit Wasser und gib 5-10 Tropfen des Bromthymolblaus hinzu (Abb. 2.1).
- Zünde das Teelicht an und lass es etwa eine Minute an der Wasseroberfläche schwimmen.
- Flute den Zylinder mit Sauerstoff aus einer Gasflasche und stülpe den Zylinder über das brenennde Teelicht (Abb. 2.2). Am besten stellst du den Zylinder nicht ganz auf dem Boden der Glasschale ab, sondern lässt einen kleinen Spalt, sodass Stoffe in den Zylinder hinein und auch wieder hinaus gelangen können.
- Warte 5 Minuten ab und beobachte, was passiert.
Tipps
Nachdem du das Experiment 5-10 Minuten beobachtet hast, kannst du in die Glasschale Eiswürfel geben und beoachten, was dann passiert.
Hinweise zur Entsorgung
Du kannst die Lösung in den Abfluss geben.
Aufgabe
Führe das Experiment durch und notiere deine Beobachtung.
Erkläre, was bei dem Experiment auf Teilchenebene passiert ist. Welche Reaktionen haben stattgefunden?
Aufgabe
Aufgabe
a) Beschreibe, welche Auswirkungen die Versauerung des Oberflächenwassers auf die Tiefwasserregionen hat.
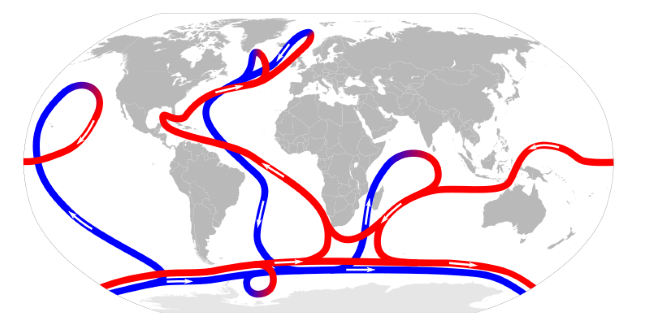
b) In diesem Experiment hast du eine vertikal verlaufende Konvektion kennengelernt. In den Ozeanen gibt es noch eine Menge mehr Strömungen, die durch unterschiedliche Eigenschaften beeinflusst werden: z.B. Wassertemperaturen, Salzgehalte, Gezeiten, Erdumdrehung. In Abbildung 3 siehst du die thermohaline Zirkulation der Ozeane. Diese Meeresströmungen werden durch unterschiedliche Temperaturen, ähnlich wie in dem Experiment, verursacht.
Diskutiere, welche Auswirkungen ein erhöhter Ausstoß von Kohlenstoffdioxid und die Erderwärmung auf die Ozeane haben. Bedenke dabei auch, dass im kalten Wasser mehr Kohlenstoffdioxid gelöst werden kann, als im warmen Wasser.