Hinweise zum Experiment
Damit in Chemie bzw. beim Experimentieren keine Unfälle passieren, musst du auf die Sicherheit achten. Die Sicherheit ist immer wichtig, wenn du in einem Fachraum oder Labor bist. Bitte beachte bei allen Experimenten die Hinweise zur Sicherheit im Labor. Die Durchführung des Experiments erfordert eine Gefährdungsbeurteilung durch die Lehrkraft.
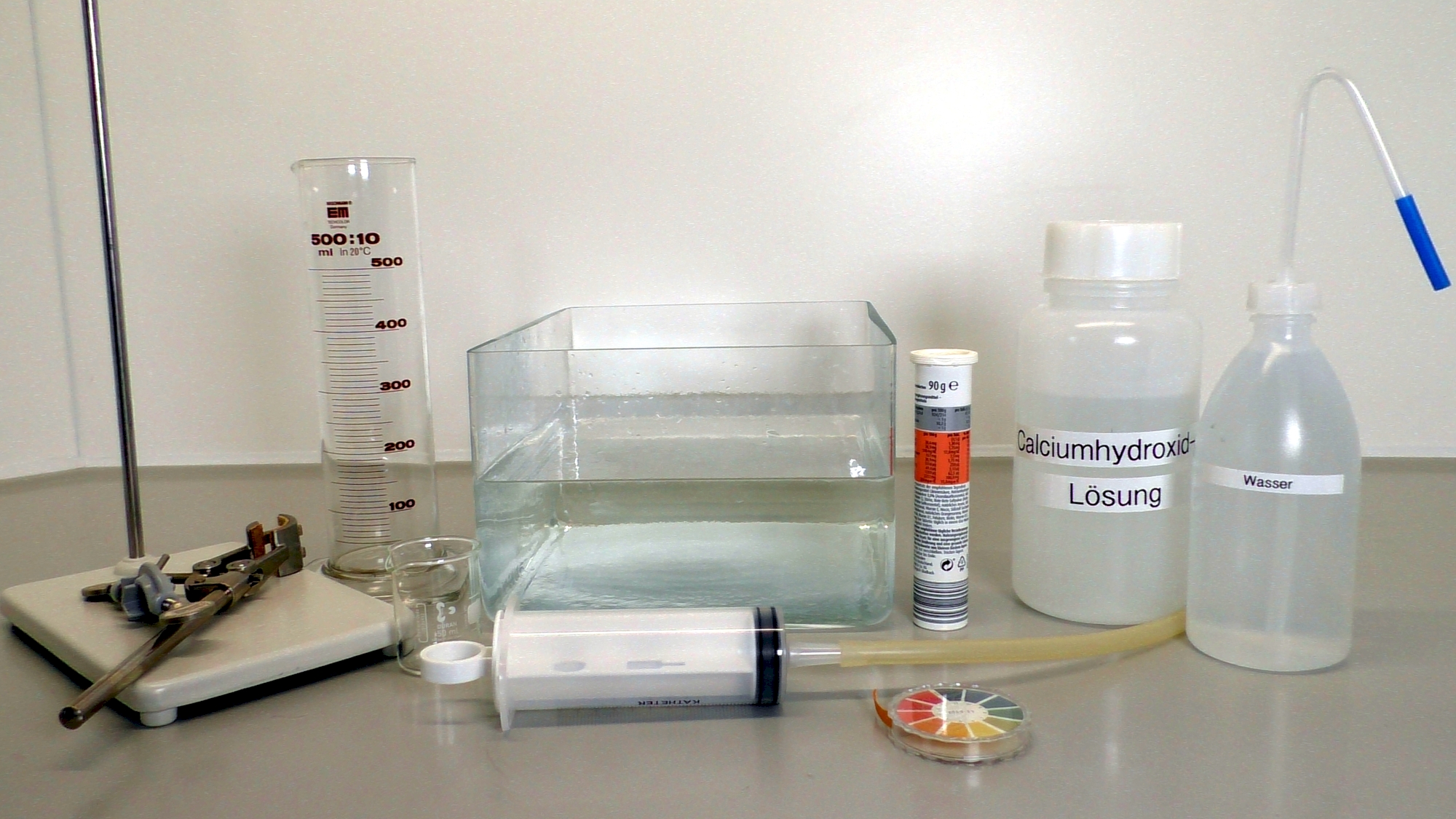
Material
- Pneumatische Wanne
- Messzylinder $\ce{500 ml}$
- Stativ mit Muffe und Klemme
- Spritze mit Schlauch
- Becherglas $\ce{50 ml}$
- optional: Tiegelzange
Chemikalien
- Brausetablette
- pH-Papier
- Wasser
- Calciumhydroxid-Lösung (Kalkwasser) (Abb. 1)
Edukte
| Stoffname | Summenformel | Gefahrenhinweise |
|---|---|---|
| Wasser | \(\ce {H2O} \) |
Kein gefährlicher Stoff nach GHS.
Kein gefährlicher Stoff nach GHS.
|
| Natriumhydrogencarbonat | $\ce{NaHCO3}$ | Link zur GESTIS-Stoffdatenbank |
| Calciumhydroxid | \(\ce{Ca(OH)2}\) |
H315: Verursacht Hautreizungen.
H318: Verursacht schwere Augenschäden.
H335: Kann die Atemwege reizen.
P280: Augenschutz/Gesichtsschutz tragen
P305+P351+P338: BEI KONTAKT MIT DEN AUGEN: Einige Minuten lang behutsam mit Wasser spülen. Eventuell vorhandene Kontaktlinsen nach Möglichkeit entfernen. Weiter spülen.
|
| Citronensäure | \(\ce {C6H8O7} \) |
H319: Verursacht schwere Augenreizung.
H335: Kann die Atemwege reizen.
P264: Nach Gebrauch Haut gründlich waschen.
P280: Augenschutz/Gesichtsschutz tragen
P305+P351+P338: BEI KONTAKT MIT DEN AUGEN: Einige Minuten lang behutsam mit Wasser spülen. Eventuell vorhandene Kontaktlinsen nach Möglichkeit entfernen. Weiter spülen.
P337+P313: Bei anhaltender Augenreizung: Ärztlichen Rat einholen/ärztliche Hilfe hinzuziehen.
|
Produkte
| Stoffname | Summenformel | Gefahrenhinweise |
|---|---|---|
| Kohlenstoffdioxid (als Reaktionsprodukt) | \(\ce {CO_2} \) |
Kein gefährlicher Stoff nach GHS.
P403: An einem gut belüfteten Ort aufbewahren.
|
| Trinatriumcitrat-2-Hydrat | $\ce{Na3C6H5O7*2H2O}$ | Link zur GESTIS-Stoffdatenbank |
| Wasser | \(\ce {H2O} \) |
Kein gefährlicher Stoff nach GHS.
Kein gefährlicher Stoff nach GHS.
|
| Calciumcarbonat | \(\ce{CaCO3}\) |
Kein gefährlicher Stoff nach GHS.
Kein gefährlicher Stoff nach GHS.
|
Versuchsaufbau/Durchführung
Vorbereitung des Experiments
- Fülle die pneumatische Wanne zur Hälfte mit kaltem Wasser (Abb. 2)
- Befülle den Messzylinder mit Wasser aus der pneumatischen Wanne komplett bis zum oberen Rand.
- Verschließe den Messzylinder mit einer Hand, drehe den Zylinder so, dass die Öffnung nach unten zeigt. Lasse die mit der Hand verschlossene Zylinderöffnung unter die Wasseroberfläche in der pneumatischen Wanne ragen und nimm dann deine Hand aus dem Wasser.
- Befestige den Messzylinder an dem Stativ so, dass er keinen Kontakt zum Boden der pneumatischen Wanne hat.
- Notiere den Füllstand der Luftblase im Standzylinder, falls eine vorhanden ist.
Bei diesem Versuch musst du die Skala des Messzylinders über Kopf lesen und auch ein wenig rechnen. Wir zeigen dir wie:
In unserem Beispiel haben wir ganz am Anfang eine Luftblase von $\ce{20 ml}$ (Abb. 3.1).
Nach der ersten Brausetablette lesen wir einen Füllstand von $\ce{130 ml}$ ab (Abb. 3.2). Jetzt müssen wir noch den Anfangsfüllstand abziehen, um herauszufinden, wie viel Gas entstanden ist: $\ce{130 ml – 20 ml = 110 ml}$. $\ce{110 ml}$ Gas haben sich im Messzylinder gesammelt.
Nach der zweiten Brausetablette lesen wir einen Füllstand von $\ce{160 ml}$ ab (Abb. 3.3). Wir ziehen alle Gasmengen ab, die zuvor vorhanden waren: $\ce{160 ml – 130 ml = 30 ml}$. Bei der zweiten Brausetablette haben sich $\ce{30 ml}$ Gas im Messzylinder gesammelt.
Durchführung mit der Brausetablette
- Halte (z.B. mit einer Tiegelzange) eine Brausetablette unter die Öffnung des Messzylinders (Abb. 4.1).
- Notiere den Füllstand des Gases, nachdem sich die Brausetablette komplett gelöst hat.
- Wiederhole den Vorgang mit einer zweiten Brausetablette und notiere wieder den Füllstand des Gases.
- Falls du möchtest, kannst du auch noch eine dritte Brausetablette unter dem Standzylinder platzieren und den Füllstand notieren.
Wiederholung mit warmem Wasser
- Führe das komplette Experiment anschließend noch einmal mit warmem Wasser durch.
Überprüfung des pH-Wertes.
- Nimm einen kurzen Streifen des pH-Papiers und überprüfe den pH-Wert der wässrigen Lösung, indem du ihn in das Wasser eintauchst (Abb. 4.2).
Überprüfung des Gases
- Führe den Schlauch der Spritze in den gasgefüllten Raum des Messzylinders (Abb. 5.1).
- Entnimm mithilfe der Spritze etwas von dem Gas.
- Fülle das \(\ce{50 ml}\) Becherglas zur Hälfte mit der Calciumhydroxid-Lösung.
- Führe über den Schlauch das Gas aus der Spritze in die Calciumhydroxid-Lösung (Abb. 5.2).
Tipps und Tricks
Falls du die Farbe vom pH-Papier nicht genau ablesen kannst, nimm eine Pipette oder einen Glasstab, um einen Tropfen der Lösung aus der pneumatischen Wanne auf das pH-Papier zu geben, anstatt das pH-Papier direkt in die Lösung zu halten.
Du kannst auch ein pH-Meter für genaue Messungen verwenden.
Hinweise zur Entsorgung
Die Lösungen kannst du in den Abfluss geben.
Aufgabe
Aufgabe
Führe das Experiment durch und notiere deine Beobachtungen.
Erkläre deine Beoabachtungen mit den chemischen Prozessen bzw. Reaktionen, die stattgefunden haben.
Aufgabe
Aufgabe
Die Ozeane sind ein riesiger Kohlenstoffdioxid-Speicher. In gewissen Maßen gleichen sie den Kohlenstoffdioxid-Gehalt in der Atmosphäre aus. Diskutiere, welche Auswirkungen die Erderwärmung bzw. die Erwärmung der Ozeane auf die Atmosphäre hat.