Warum solltest du im Chemieunterricht die Gefäße immer direkt verschließen, nachdem du Chemikalien daraus entnommen hast? Einige Chemikalien verflüchtigen schnell. Das heißt, dass der Stoff bei Raumtemperatur in die Gasphase übergeht und gasförmig wird. Wenn du ein Gefäß mit Wasser offen stehen lässt und das Wasser verdunstet, ist das nicht gefährlich für dich. Bei nicht gut verschlossenen Chemiekalien-Behälter können aber auch Stoffe in deine Nase gelangen, die unerwünschte Reaktionen in deinem Körper hervorrufen. Und die gasförmigen Chemikalien können auch mit anderen Chemikalien reagieren.
In Säure-Base-Reaktionen können ebenfalls Gase als Säure bzw. Base wirken. Sei gespannt, was passiert, wenn du aus Versehen ein Gefäß mit Hydrogenchlorid und ein Gefäß mit Ammoniak nebeneinander offenstehen lässt.
Warum Säure-Base-Reaktionen nach Brönsted auch ohne Wasser möglich sind
In dem Artikel zu der Definition von Säure-Base-Reaktionen nach Brönsted hast du gelernt, dass Säure-Base-Reaktionen immer zwischen zwei Reaktionspartnern stattfinden. Ein Reaktionspartner gibt eines oder mehrere Protonen ab, die der andere Reaktionspartner aufnimmt. Beim Beispiel „Lösen von Hydrogenchlorid in Wasser“ wird deutlich, dass Wasser-Moleküle der Reaktionspartner der Hydrogenchlorid-Moleküle sind. Damit Protonenübergänge stattfinden können, muss aber nicht immer Wasser anwesend sein. Dies zeigen wir dir hier am Beispiel mit zwei Gasen.
Säure-Base-Reaktion von zwei Gasen
Lässt du jeweils ein Gefäß mit Hydrogenchlorid und mit Ammoniak offen stehen, verflüchtigen die Flüssigkeiten schnell. Dabei gehen das Hydrogenchlorid ($\ce{HCl}$) und Ammoniak ($\ce{NH3}$) in den gasförmigen Zustand über. In dem folgenden Video (Abb. 1) kannst du besonders gut erkennen, was passiert, wenn diese beiden Gase in einer Säure-Base-Reaktion miteinander reagieren. Noch genauer kannst du die Reaktion in der Animation (Abb. 2) sehen.
Beobachtung
Du siehst einen weißen Rauch, dessen feste Bestandteile sich nach und nach auf dem Boden absetzen.
Erklärung
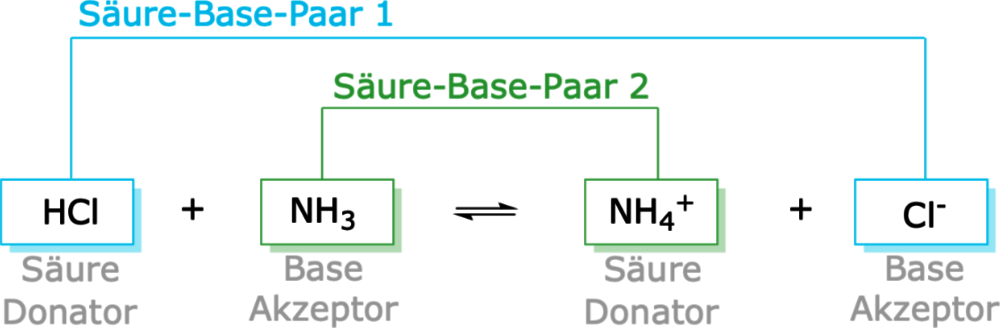
Hydrogenchlorid-Gas ($\ce{HCl}$) und Ammoniak-Gas ($\ce{NH3}$) reagieren in dieser Reaktion zum festen Ammoniumchlorid ($\ce{NH4Cl}$), welches eine Salz-Verbindung ist (Abb. 3). Bei dieser Reaktion gibt das Chlorwasserstoff-Molekül ein Proton an das Ammoniak-Molekül ab (Abb. 4). Das Chlorwasserstoff-Molekül wirkt als Brönsted-Säure und das Ammoniak-Molekül als Brönsted-Base.
An Protonenübergängen müssen also nicht immer Wasser-Moleküle beteiligt sein. Sie können auch direkt zwischen Teilchen formuliert werden, dessen Stoffe aufgrund ihres Verhaltens gegenüber Wasser als Säuren oder Basen bezeichnet werden.
Zusammenfassung
Säure-Base-Reaktion müssen nicht unbedingt in wässrigen Lösungen stattfinden. Die Ammoniumchlorid-Synthese zeigt, dass auch Gase miteinander eine Säure-Base-Reaktion eingehen können. Bedeutend dabei ist, dass nach der Brönsted-Definition Protonen von dem einen zum anderen Reaktionspartner übertragen werden.