Du kannst den pH-Wert von einer Lösung mit dem pH-Papier messen und bekommst ein ungefähres Ergebnis. Beim Messen des pH-Wertes sind pH-Meter schon genauer. Der pH-Wert deines Blutes liegt zwischen 7,35 und 7,45. In manchen Fällen müssen wir einen pH-Wert genau messen oder berechnen können, weil schon kleinste Abweichungen große Folgen haben können.
Es kann auch sein, dass z.B. eine Handseife einen genauen pH-Wert besitzen muss, damit sie besonders gut zu dem pH-Wert deiner Haut passt (Abb. 1). Bei der Produktion der Handseife soll der genaue pH-Wert erreicht werden, ohne verschiedene Mischverhältnisse ausprobieren zu müssen.
Wir erklären dir in diesem Artikel, wie du den pH-Wert berechnen kannst.
Wasser steht im Säure-Base-Gleichgewicht
Berechnung des Ionenprodukts des Wassers über das Massenwirkungsgesetz
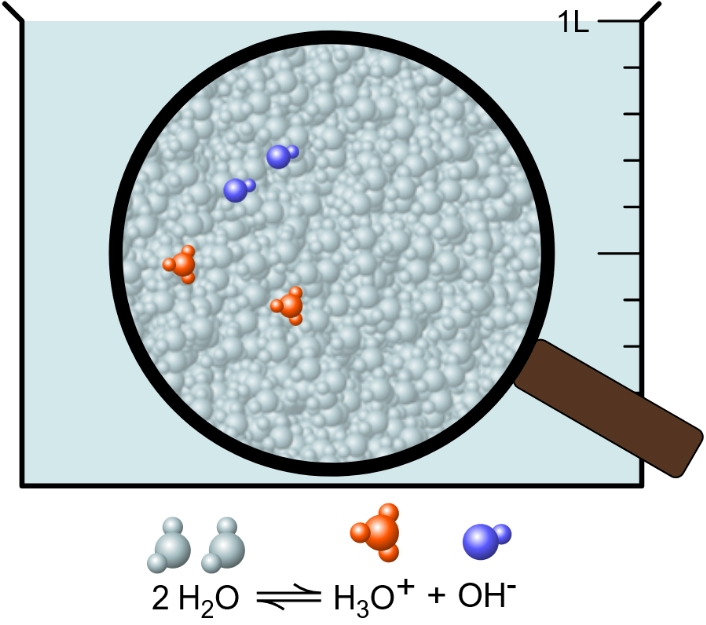
Du leitest den pH-Wert von der Konzentration der Oxonium-Ionen im dynamischen Gleichgewicht des Wassers ab. Das dynamische Gleichgewicht des Wassers kennst du als folgende Reaktion:
\(\ce{2 H2O <=> H3O^+ + OH^-}\)
Auf der Teilchenebene erkennst du, dass die Teilchenzahl der Oxonium- und Hydroxid-Ionen gleich ist (Abb. 2). Von den Wasser-Molekülen ist in der Lösung eine bedeutend größere Anzahl an Teilchen als von Oxonium- und Hydroxid-Ionen vorhanden.
Für diese Reaktion stellst du wieder das Massenwirkungsgesetz mit der Gleichgewichtskonstante \(K\) auf. Im Zähler notierst du dabei die Konzentration der Oxonium- und Hydroxid-Ionen. Die Konzentration der Wasser-Moleküle zum Quadrat wird im Nenner notiert:
\(K = \dfrac{c\,(\ce{H3O+})\cdot c\,(\ce{OH-})}{c^2\,(\ce{H2O})}\)
Dadurch, dass in dem Gleichgewicht der Anteil an Wasser-Molekülen \(\ce{H2O}\) um einiges größer ist als der Anteil an Oxonium- \(\ce{H3O^+}\) und Hydroxid-Ionen \(\ce{OH^-}\) (Abb. 2), hat eine Änderung der Konzentration der Wasser-Moleküle keinen großen Einfluss auf die mathematische Berechnung. Deshalb kannst du nun die Konzentration der Wassermoleküle zum Quadrat multiplizieren, um die Konstante \(K_W\) zu erhalten.
\(K = \dfrac{c\,(\ce{H3O+})\cdot c\,(\ce{OH-})}{c^2(\ce{H2O})}\mid \cdot c^2\,(\ce{H2O})\)
\(K\cdot c^2\,(\ce{H2O}) = K_W = c\,(\ce{H3O+})\cdot c\,(\ce{OH-})\)
Die Konstante \(K_W\) wird als das Ionenprodukt des Wassers bezeichnet, weil diese aus dem Produkt der Konzentration der Oxonium- und Hydroxid-Ionen berechnet wird. Bei 25°C Raumtemperatur hat das Ionenprodukt des Wassers immer den Wert
\(K_W = 1,0 \cdot 10^{-14} \dfrac{mol^2}{l^2}\).
Multiplizierst du Potenzen mit der gleichen Basis, dann kannst du einfach die Exponenten addieren. Bei der Berechnung des Ionenprodukts haben wir jeweils die Basis „10“. Die Exponenten sind hier jeweils „-7“. Das gleiche Rechengesetz wendest du auch auf die Einheit an.
\(\ce K_W = c\,(\ce{H3O+})\cdot c\,(\ce{OH-})\)
\(\ce K_W=10^{-7}\dfrac{mol}{l} \cdot 10^{-7}\dfrac{mol}{l}\)
\(\ce K_W = 10^{-14}\dfrac{mol^2}{l^2}\)
Berechnung der Konzentration der Oxonium- und Hydroxid-Ionen über das Ionenprodukt
Mithilfe des Ionenprodukts kannst du jetzt berechnen, wie hoch die Konzentration der Oxonium- und Hydroxid-Ionen in einer neutralen Lösung ist. Du weißt, dass die Konzentration der Oxonium- und Hydroxid-Ionen gleich ist (Abb. 2):
\(c\,(\ce{H3O+}) = c\,(\ce{OH-})\)
In der Gleichung des Ionenproduktes könntest du also auch die Konzentration der Oxonium-Ionen mit sich selbst multiplizieren oder die Konzentration der Hydroxid-Ionen mit sich selbst multiplizieren. Daraus ergibt sich die folgende Gleichung:
\(c^2\,(\ce{H3O+}) = c^2\,(\ce{OH-}) = 10^{-14} \dfrac{mol^2}{l^2}\)
Rechne nun mit der Konzentration der Oxonium-Ionen weiter. Diese dient uns nämlich als Maß für den pH-Wert.
\(c^2\,(\ce{H3O+}) = 10^{-14} \dfrac{mol^2}{l^2}\)
Um das Quadrat der Konzentration aufzulösen, ziehe auf beiden Seiten der Gleichung die Wurzel:
\(c^2\,(\ce{H3O+}) = 10^{-14} \dfrac{mol^2}{l^2}\mid \sqrt{}\)
\(\sqrt{c^2\,(\ce{H3O+})} = \sqrt{10^{-14} \dfrac{mol^2}{l^2}}\)
\(c\,(\ce{H3O+}) = 10^{-7} \dfrac{mol}{l}\)
In einer neutralen Lösung beträgt die Konzentration an \(\ce{H3O+}\)-Ionen somit \(10^{-7} \dfrac{mol}{l}\).
Berechnung des pH-Wertes über die Konzentration der Oxonium-Ionen
Für die Berechnung des pH-Wertes verwendest du die Konzentration der Oxonium-Ionen. Zur Vereinfachung im Umgang mit den Potenzzahlen wurde der pH-Wert eingeführt. Du weißt jetzt, dass reines Wasser eine Konzentration an Oxonium-Ionen von \(\ce{c(H3O^+)} = 10^{-7} \dfrac{mol}{l}\) hat.
Um den pH-Wert zu berechnen, nimmst du von der Konzentration der Oxonium-Ionen den negativen dekadischen Logarithmus:
\(\ce {pH = -lg\,(c\,(\ce{H3O+}))}\)
\(\ce {pH = -lg\,(10^{-7}\dfrac{mol}{l})}\)
\( \ce {pH = 7} \)
Die Einheit fällt bei dieser Rechnung weg. Der pH-Wert beschreibt den Exponenten einer Konzentration, allerdings mit umgedrehten Vorzeichen. Reines Wasser hat einen pH-Wert von 7.
Berechnung des pH-Wertes über die Konzentration der Hydroxid-Ionen
Saure und basische Lösungen können auch über die Konzentration der \(\ce{OH-}\)-Ionen beschrieben werden. Den negativen Zehnerlogarithmus des Wertes der Konzentration an \(\ce{OH-}\)-Ionen nennen wir in der Chemie \(\ce {pOH}\)-Wert.
\( \ce {pOH\,=\,-lg\,(c\,({OH^-}))} \)
Das oben formulierte Ionenprodukt des Wassers kannst du auch logarithmisch formulieren:
\(\ce{pH + pOH = 14}\)
Über diese Gleichung kannst du einfach von einem pH-Wert auf den entsprechenden pOH-Wert schließen. So hat Zitronensaft mit einem pH-Wert von 2,4 einen pOH-Wert von 11,6, während Beton mit einem pH-Wert von 12,6 einen pOH-Wert von 1,4 aufweist.
Wenn du den dekadischen Logarithmus von einer Zahl, die eine Basis von 10 und eine beliebige Zahl des Exponenten hat, ist das Ergebnis die Zahl des Exponenten. Durch das negative Logarithmieren dreht sich das Vorzeichen der Zahl vom Exponenten um. Das heißt, aus \(\mathrm{+}\) wird \(\mathrm{-}\) und aus \(\mathrm{-}\) wird \(\mathrm{+}\).
Was passiert, wenn sich das Säure-Base-Gleichgewicht verschiebt
Reagiert eine Lösung sauer oder basisch, sind die Konzentrationen von \(\ce{H3O+}\)-Ionen und \(\ce{OH-}\)-Ionen verschieden - aber der Wert des Ionenproduktes als ein Konstante muss gleich sein. Gibst du in Wasser etwas von einer Säure, dann nimmt die Konzentration der \(\ce{H3O+}\)-Ionen zu. Der Wert des Ionenproduktes ist immer noch \(10^{-14}\frac{mol^2}{l^2}\). Somit muss die Konzentration an \(\ce{OH-}\)-Ionen so weit abnehmen, bis wieder genau der Wert der Gleichgewichtskonstanten erreicht ist.
In Abbildung 3 kannst du erkennen, wie zuerst das Gleichgewicht von Wasser eingestellt ist (hellgraue Teilchen im Hintergrund=Wasser, dunkelblaue Teilchen=Hydroxid-Ionen, rote Teilchen=Oxonium-Ionen). Bei Zugabe einer Säure steigt die Konzentration der Oxonium-Ionen (hellgraue Teilchen im Hintergrund=Wasser, dunkelgraue Teilchen=Säure, hellblaue Teilchen=Säurerest-Ionen, rote Teilchen=Oxonium-Ionen). Die Oxonium-Ionen stehen nicht nur im Gleichgewicht zu den Wasser-Molekülen, sondern auch zu den Säure-Molekülen. Wie du bei sauren und basischen Lösungen den pH-Wert berechnest, kannst du im Aufgabenbereich üben.
Zusammenfassung
Wasser steht in einem dynamischen Gleichgewicht $\ce{2 H2O <=> H3O^+ + OH^-}$. Für die Berechnung des pH-Wertes kannst du die Konzentration der Wasser-Moleküle vernachlässigen. Die Konzentration der Oxonium- und Hydroxid-Ionen ist gleich. Die Konzentration der Oxonium- und Hydroxid-Ionen ist in einer neutralen Lösung immer \(10^{-7} \frac{mol}{l}\). Den pH-Wert einer Lösung berechnest du über den negativen Logarithmus der Konzentration der Oxonium-Ionen. Bei einer neutralen Lösung kommt bei dieser Rechnung der pH-Wert 7 heraus.