Du hast bereits die besonderen Eigenschaften von Metallen kennengelernt: elektrische Leitfähigkeit, gute Wärmeleitfähigkeit, metallischer Glanz und Verformbarkeit. Doch wieso haben alle Metalle diese Eigenschaften gemeinsam? Um das erklären zu können, müssen wir uns den Aufbau von Metallen auf der Teilchenebene genauer anschauen.
Das Elektronengasmodell
Metalle liegen in der Regel als Feststoffe vor, das heißt die Atome liegen dicht zusammen und geordnet vor – wir sprechen von einem Metallgitter. Die Metall-Atome sind, wie alle anderen Atome auch, aus einem positiv geladenen Atomkern und einer negativ geladenen Atomhülle aus Elektronen aufgebaut. Einige der Elektronen werden vom Atomkern nur schwach angezogen. Sie können sich also innerhalb des Metallgitters frei bewegen. Da diese Elektronen nun nicht mehr bei ihren ursprünglichen Atomen sind, entstehen positiv geladene Metall-Atomrümpfe.
Diese Atomrümpfe sind an festen Plätzen im Metallgitter angeordnet, wo sie nur leicht vibrieren. Sie werden von den frei beweglichen negativ geladenen Elektronen umgeben. Insgesamt ist das Metallgitter also nach Außen ungeladen. Da die Elektronen sich ähnlich wie die Teilchen eines Gases bewegen, sprechen wir vom sogenannten Elektronengas. Das Modell, welches die Teilchenebene von Metallen beschreibt, nennen wir daher auch Elektronengasmodell (Abb. 1). Das negativ geladene Elektronengas und die positiv geladenen Atomrümpfe ziehen sich gegenseitig an, wodurch die Metall-Atome zusammengehalten werden. Doch wie können wir mithilfe des Elektronengasmodells die verschiedenen Eigenschaften von Metallen erklären?
Abb. 1 Animation Elektronengasmodell
Metallischer Glanz
Alle Metalle haben einen typischen metallischen Glanz. Das liegt daran, dass das Elektronengas die Atomrümpfe umhüllt. Trifft Licht auf ein Metall, wird das Licht vollständig reflektiert. Da die Lichtwellen immer auf ein Elektron treffen, wird dadurch die Lichtwelle reflektiert (Abb. 2).
Elektrische Leitfähigkeit
Wenn ein Stoff elektrisch leitfähig ist, dann heißt das, dass es frei bewegliche Ladungsträger gibt. Betrachten wir das Elektronengasmodell, sind die Elektronen die Ladungsträger. Du kannst sehen, dass die negativ geladenen Elektronen des Elektronengases frei beweglich sind. Wird also elektrische Spannung angelegt, bewegen sich die Elektronen zum Pluspol und über den Minuspol gelangen wieder Elektronen in das Metallgitter, sodass die Elektronenanzahl im Metallgitter unverändert bleibt (Abb. 3).
Abb. 3 Animation Elektronenfluss beim Anlegen von Spannung
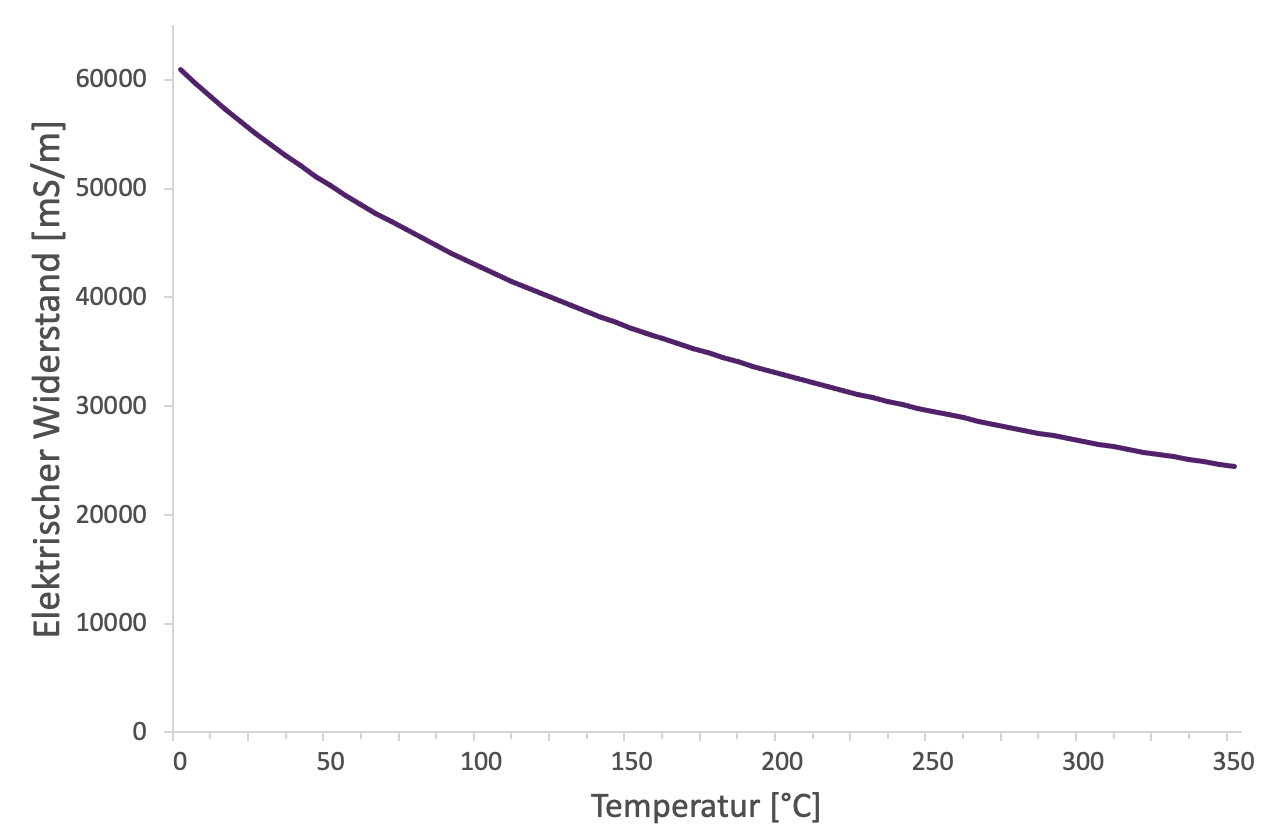
Wenn du ein Metall erhitzt, kannst du beobachten, dass die elektrische Leitfähigkeit sinkt (Abb. 4).
Doch woran liegt das? Wir wissen bereits, dass die Teilchen sich bei einer höheren Temperatur stärker bewegen. Doch sollte die elektrische Leitfähigkeit dann nicht steigen? Wird die Temperatur erhöht, bewegen sich vor allem die Atomrümpfe stärker. Wenn die Elektronen sich dann in Richtung des Pluspols bewegen, stoßen sie häufiger an einen Atomrumpf. Dadurch wird die Beweglichkeit der Elektronen in Richtung des Pluspols eingeschränkt, so dass das Metall den elektrischen Strom schlechter leitet.
Wärmeleitfähigkeit
Schauen wir uns als nächstes an, warum Metalle so gute Wärmeleiter sind. Du kennst das folgende Phänomen aus dem Alltag: du machst dir einen Tee und lässt den Löffel in der Tasse. Nach kurzer Zeit möchtest du den Tee umrühren und der Löffel ist auch oben heiß, obwohl nur der untere Teile des Löffels im heißen Tee stand. Warum ist das so? Wenn die Temperatur erhöht wird, bewegen sich die Atomrümpfe im Metallgitter stärker. Diese stoßen dann mit den frei beweglichen Elektronen zusammen, wodurch auch diese sich stärker bewegen. Diese Bewegung kann vom Elektronengas wiederum auf die benachbarten Atomrümpfe übertragen werden. Dadurch wird die stärkere Bewegung nach und nach auf alle Atomrümpfe innerhalb des Metallgitters übertragen. Wir nehmen diese erhöhte Teilchenbewegung als eine höhere Temperatur wahr. Deshalb fühlt sich der Löffel in einer Tasse Tee sehr schnell auch oben heiß an.
Verformbarkeit
Schauen wir uns als letztes noch die Verformbarkeit von Metallen an. Übst du Druck auf ein Metall aus, bricht es nicht, sondern wird verbogen. Dies lässt sich ebenso mit dem Elektronengasmodell erklären: Wird Druck auf ein Metall ausgeübt, werden die positiv geladenen Atomrümpfe verschoben, sodass diese zum Teil näher zusammen sind. Diese stoßen sich eigentlich gegenseitig ab, da sie alle positiv geladen sind. Das Elektronengas ist aber noch immer zwischen den Atomrümpfen und sorgt dafür, dass diese weiterhin zusammengehalten werden (Abb. 5.1 und 5.2).