Jeder kennt das Problem aus dem Alltag: Viele Werkstoffe verändern sich, wenn sie Luft und Wasser ausgesetzt sind. Sie werden von der Oberfläche her zerstört. Man spricht dabei von Korrosion. Dieser Begriff wird auch in der Elektrochemie verwendet, wenn zwei Stoffe (meist Metalle) miteinander reagieren, wobei einer stark angegriffen wird oder sich auflöst. Allgemein gilt bei einem elektrochemischen Korrosionsvorgang, dass die Korrosionsvorgänge auf der Metalloberfläche in Verbindung mit einer elektrisch leitenden Flüssigkeitsschicht, dem Elektrolyten (meist Wasser), ablaufen. Als Elektrolyt genügt hierbei ein hauchdünner Feuchtigkeitsfilm, beispielsweise ein Wassertropfen, aber auch Handschweißflecken auf Werkstücken.
Die meisten dieser Vorgänge lassen sich auf zwei Arten der Korrosion zurückfuhren: Bei der Säure-Korrosion werden Metalle durch Oxonium-Ionen \(\ce{(H_3O^+)}\), bei der Sauerstoff-Korrosion durch Sauerstoff oxidiert.
Säure-Korrosion
Stellt man ein Zink-Blech und ein Kupfer-Blech in verdünnte Säure, bleibt das edlere Metall, in diesem Fall Kupfer, unverändert, wohingegen sich am unedlen Zink langsam Wasserstoff-Bläschen bilden. Berühren sich die beiden Bleche, so zeigt sich am Kupfer-Blech eine starke Wasserstoff-Entwicklung. (siehe Abb. 1)
Am Zink-Blech bilden sich \(\ce{Zn^{2+}}\)-Ionen, welche die Entladung der Oxonium-Ionen \(\ce{(H_3O^+)}\) behindern. Sobald sich die beiden Metalle berühren, fließen die freigesetzten Elektronen vom unedlen Zink zum edleren Kupfer und stehen dort für die Entladung der Oxonium-Ionen zu Wasserstoff-Molekülen zur Verfügung. Insgesamt verläuft die Redoxreaktionen nun wesentlich schneller als bei Zink alleine.
Oxidation: $\ce{Zn (s) -> Zn^{2+}(aq) + 2e^-}$
Reduktion: $\ce{2 H^+ (aq) + 2e^- -> H_2 (g) ^}$
Durch den direkten Kontakt von Zink und Kupfer im sauren Elektrolyten entsteht ein sogenanntes Lokalelement. Als Lokalelement bezeichnet man kleine Korrosionsstellen, die mit dem bloßen Auge nicht zu erkennen sind. Sie entstehen dort, wo sich unterschiedliche Metalle berühren und ein Elektrolyt (Feuchtigkeit, in der Regel Wasser) vorhanden ist. Dabei bilden die verschiedenen Metalle eine galvanische Zelle, die durch den Elektrolyten kurzgeschlossen ist. Das unedlere Metall wird anodisch abgebaut. Lokalelemente entstehen auch, wenn ein Metall mit geringen Mengen eines anderen Metalls verunreinigt ist, zum Beispiel in Legierungen.
Sauerstoff-Korrosion
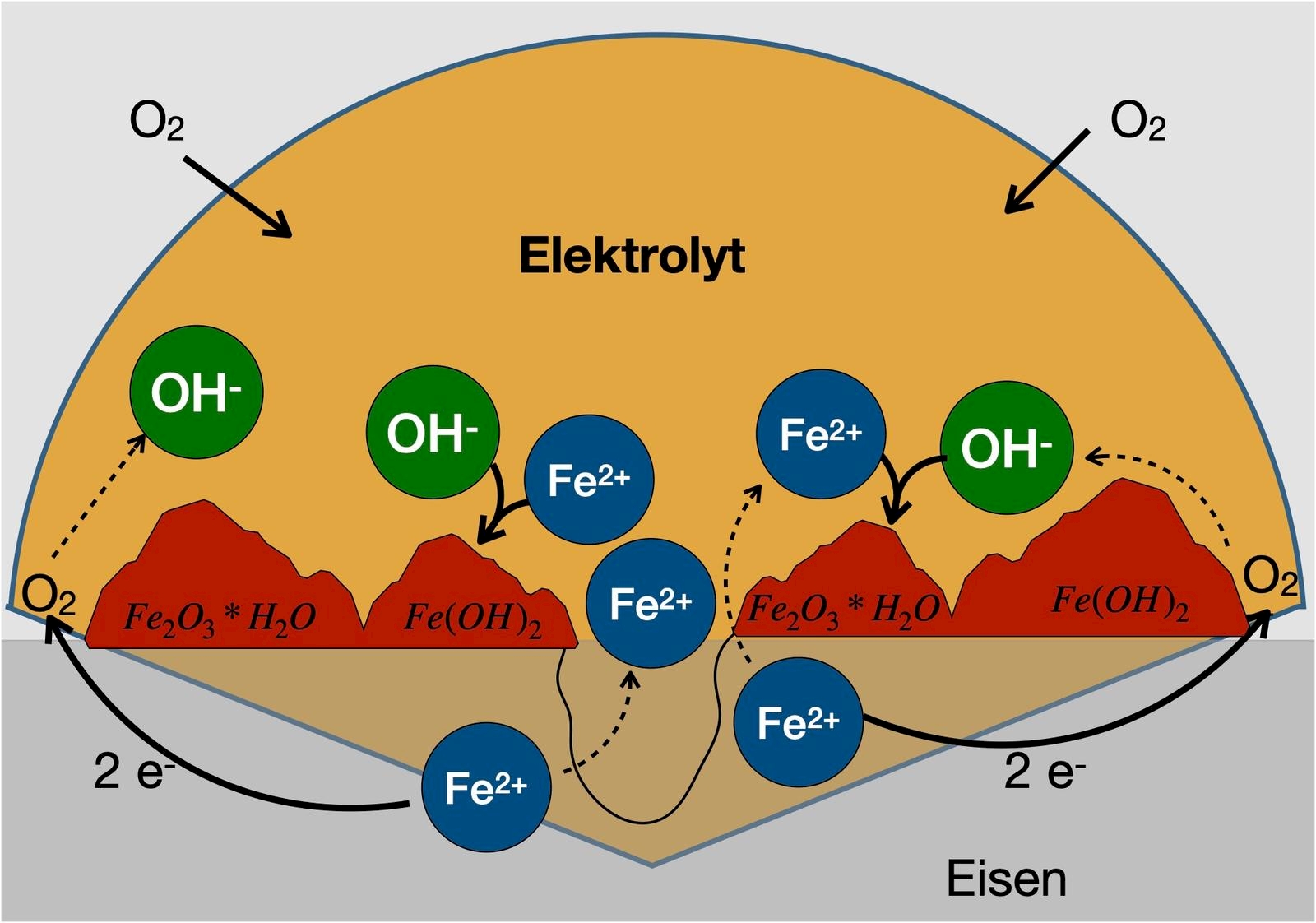
Die Korrosion von Eisen mit charakteristischer Bildung von Rost beruht ebenfalls auf der Bildung eines Lokalelements. Entscheidend für die Zerstörung des Eisens ist dabei der im Wasser gelöste Luftsauerstoff: Er oxidiert das unedle Eisen, wobei Eisen(II)-Ionen entstehen. Die Sauerstoff-Moleküle werden unter Bildung von Hydroxid-Ionen reduziert.
Oxidation: $\ce{2 Fe (s) -> 2 Fe^{2+}(aq) + 4e^-}$
Reduktion: $\ce{O2(g) + 2 H2O (aq) + 4e^- -> 4 OH- (aq)}$
Redoxreaktion: $\ce{2 Fe (s) + O2(g) + 2 H2O (aq) -> 2 Fe^{2+}(aq) 4 OH^- (aq)}$
In sauerstoffreichen Umgebungen entstehen bevorzugt Hydroxid-Ionen, während Eisen(II)-Ionen hauptsächlich in sauerstoffarmen Umgebungen gebildet werden. Mit Hilfe der Diffusion können Eisen(II)- Ionen und Hydroxid-Ionen zwischen den beiden Bereichen miteinander reagieren und einen Niederschlag von Eisen(II)-hydroxid bilden.
$\ce{Fe^{2+} (aq) + 2 OH^- (aq) -> Fe(OH)_2 (s)}$
Das Eisen(II)-hydroxid wird allmählich durch Luftsauerstoff zu rotbraunen, gallertartigem Eisen(II)- Oxid Hydroxid \(\ce{FeO(OH)}\) oxidiert.
$\ce{ 4 Fe(OH)_2 (s) + O2 (g) -> 4 FeO(OH) (s) + 2 H2O (aq)}$
Für diese als Rost bezeichnete, wasserhaltige Eisen(III)-oxidhydroxid-Verbindung verwendet man häufig die vereinfachte Formel \(\ce{Fe2O3*H2O}\). Gealterter, wasserarmer Rost besteht oft aus einem heterogenen Gemisch von rotbraunem Eisen(III)-oxidhydroxid und schwarzem Eisen(II)-Eisen(III)-oxid, \(\ce{Fe3O4 (FeO * Fe2O3)}\).
Die Rostschicht kann das Eisen vor weiterer Zerstörung nicht schützen, da einerseits die Stelle, an der sich das Eisen auflöst, nicht mit dem Ort der Rostbildung identisch ist und andererseits die Rostschicht im Gegensatz zu einer Aluminiumoxid-Schicht porös und für Wasser und Sauerstoff durchlässig ist. Der Korrosionsvorgang wird beschleunigt, wenn Verunreinigungen im Eisen zur Bildung von Lokalelementen führen.