Iiiihh – eine Spinne seilt sich unmittelbar vor dir von der Decke ab. Zugegebenermaßen gibt es schönere Begegnungen, aber nach dem ersten Schock solltest Du dir die Spinne und ihre Fähigkeiten dennoch näher ansehen. Spinnen können nämlich Fäden herstellen, die Chemiker neidisch beäugen. Das Spinnfadenmaterial ist einerseits unheimlich leicht und andererseits trotzdem sehr reißfest. Doch was macht solche Materialien, wie die Spinnenseide, robust? Es sind die zwischenmolekularen Wechselwirkungen zwischen den Molekülen im Spinnfaden.
Du findest hier einige weitere Beispiele aus den Haushalt und der Natur, deren Eigenschaften und Nutzen aufgrund der zwischenmolekularen Wechselwirkungen für uns von großer Bedeutung sind.
Seidentücher gegen Schussverletzungen
Ein amerikanischer Arzt notierte 1887 die Erkenntnis, dass Seide vor Schussverletzungen bewahren kann. Er erkannte, dass Opfer von Schussverletzungen durch die Seide geringeren Schaden nahmen und sogar vor dem Tode bewahrt wurden. Diese Erkenntnis wurde bei der Entwicklung schusssicherer Westen berücksichtigt. Die Westen müssen auf einer kleinen Fläche sehr großen Kräften standhalten. Die Westen bestehen heute aus synthetischen (künstlich hergestellten) Fasern, die verhindern können, dass Munition sie durchdringen kann. Das Material, aus dem die Fasern gebildet sind, heißt Kevlar. Seine Molekülstruktur ist die der Seide ähnlich und erlaubt es, dass besonders reißfeste Fasern entstehen.
Betrachtet man einen Ausschnitt aus der Polymerkette von Kevlar, erkennst du abwechselnd zur Seite abstehende Wasserstoff- und Sauerstoff-Atome. Das ist bei Peptidbindungen, die die Einzelbausteine miteinander verbinden, üblich. Die polarisierten Bindungen zwischen dem Stickstoff-Atom und Wasserstoff-Atom erlauben es, dass sich zwischen zwei Kevlar-Molekülen Wasserstoffbrücken ausbilden können (Abb. 2).
Aufgrund der Vielzahl auftretender Wasserstoffbrücken weisen die Moleküle als Fasern gesponnen eine enorm hohe Reißfestigkeit auf, die als Gewebe noch stärkere Kräfte aushalten können. Peptidbindungen sind auch die Grundlage der Spinnfaden-Proteine von Spinnen, genannt Spinnenseide. Sie ist noch stärker als Kevlar und Nylon. Nylon ist ein weiterer reißfester Kunststoff mit Peptidbindungen, aus dem Strumpfhosen oder Sicherheitsgurte gemacht werden.
Frischhaltefolie
Aus langkettigen Polyethen-Molekülen lassen sich transparente Folien herstellen. Bei der Bildung der Molekülketten entsteht zunächst ein ungeordnetes Durcheinander aus kreuz und quer übereinanderliegenden Molekülketten. Wird der Stoff in Folien gezogen und auf einer Rolle aufgewickelt, kann er als Frischhaltefolie verwendet werden. Die zwischenmolekularen Wechselwirkungen führen dazu, dass die Folie reißfest und dehnbar ist. Der Zusammenhalt erfolgt über London-Dispersions-Wechselwirkungen zwischen den einzelnen Molekülketten.
Klebstoffe
Haftnotizzettel hast du sicher schon verwendet. Vielleicht klebt sogar einer an deinem PC-Bildschirm. Der Erfinder dieser Haftnotizzettel, Spencer Silver, wollte eigentlich einen Klebstoff herstellen, der stärker ist als alle anderen bisher bekannten Klebstoffe. Stattdessen war die Klebeeigenschaft des Stoffes, der heute für Haftnotiz-Zettel verwendet wird, aber viel zu gering und wurde zunächst nicht weiterverwendet. Bei Klebstoffen ist u. a. entscheidend, dass sich zwischen Klebstoff und dem Material, das zusammengeklebt wird, zwischenmolekulare Wechselwirkungen ausbilden können. Diese führen dazu, dass die Materialien zusammenhalten. Sind die zwischenmolekularen Wechselwirkungen allerdings zu schwach, lässt sich der Gegenstand wieder rückstandsfrei ablösen. Genau diese Eigenschaft besitzt der Klebstoff für Haftnotizzettel und wird heute weltweit erfolgreich verwendet.
Verschüttetes Wasser
Du hast ein Glas Wasser verschüttet. Zum Aufwischen steht dir ein trockener und ein feuchter Lappen zur Verfügung. Welchen verwendest du? Etwas Wissen über Zwischenmolekulare Wechselwirkungen hilft dir dabei!
Wassermoleküle bilden untereinander stark wirkende Wasserstoffbrückenbindungen aus. Textilfasern sind dagegen zunächst wasserabweisend. Sie können aufgrund ihrer anderen Molekülstruktur keine Wasserstoffbrückenbindungen zu den Wasser-Molekülen ausbilden. Erst wenn sich in den Hohlräumen eines Lappens (z. B. einem Schwammtuch) Wasser eingelagert hat, kann es gut zum Aufwischen von Flüssigkeiten verwendet werden. Das liegt daran, dass aufgrund der Anziehungskräfte durch Wasserstoffbrückenbindungen zwischen den Wasser-Molekülen die Flüssigkeit besser aufgesaugt werden kann, wenn im Tuch bereits Wasser vorhanden ist.
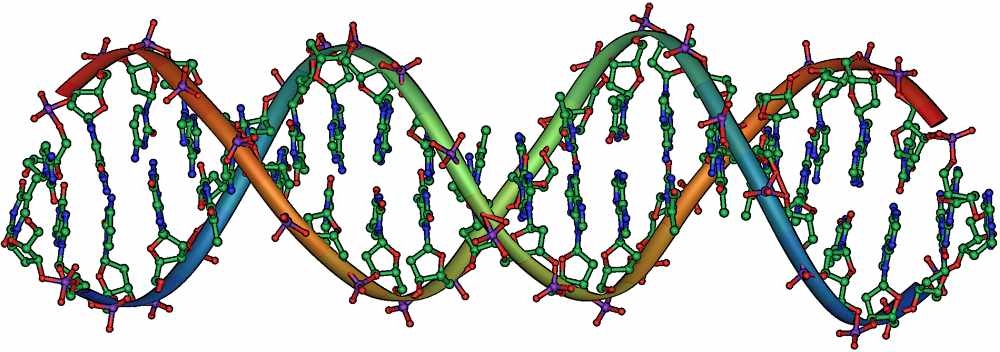
Aufbau der DNA
Bevor sich Zellen teilen können, muss die DNA einer Zelle vervielfältigt werden. Dazu müssen die beiden Einzelstränge der DNA gelöst und nach dem Ablesen verdoppelt werden. Wären die Basen, die zwischen den beiden Strängen liegen, mit festen Bindungen fixiert, wäre es kaum möglich die Stränge voneinander zu lösen. Ist die Bindung zwischen den beiden Strängen zu schwach, könnte sie sich zu leicht trennen. Die Zelle kann die Erbinformation nicht vervielfältigen, wenn die Stränge sich spontan öffnen oder zu stark schließen. Da es sich bei den Verbindungen aber um Wasserstoffbrückenbindungen handelt, können diese durch Enzyme gelockert werden. Erst ab einer Temperatur von über 90° C lösen sich die Stränge durch die hohe Temperatur auch von selbst.
Spiegelei braten
Beim Braten eines Spiegeleis kannst du erkennen, dass das Eiklar in der heißen Pfanne schnell weiß wird. Die Transparenz verschwindet zunehmend. Diese Veränderung hängt ebenfalls mit den zwischenmolekularen Wechselwirkungen in den Eiweiß-Molekülen im Eiklar zusammen. Unter Hitzeeinwirkung verändert sich die Struktur der sehr langen Eiweiß-Moleküle. Dabei wird aber nicht die Molekülkette selbst zerstört, sondern die zwischenmolekularen Wechselwirkungen innerhalb ein und desselben Eiweiß-Moleküls werden gelöst. Wasserstoffbrückenbindungen können beispielsweise innerhalb des Eiweiß-Moleküls durch Querverbindungen Schlaufen ausbilden, die zu einer charakteristischen Struktur der Eiweiße führt. Diese Tertiärstruktur kann sich unter Hitzeeinwirkung unwiederbringlich verändern. Kühlt das Eiweiß anschließend wieder ab, besitzt es weiterhin die veränderte Struktur durch neu gebildete Wasserstoffbrücken. Beim Spiegelei zeigt sich dies durch eine veränderte Farbe. Weil das Eiweiß-Molekül nun nicht mehr in seiner natürlichen Ausgangsform und mit anderen Eigenschaften vorliegt, spricht man von der „Denaturierung“ des Eiweißes.
Viskosität von Honig
Honig zu essen kann eine ganz schön klebrige Angelegenheit sein. Wenn du dagegen Blüten-Honig vom heimischen Imker einige Zeit stehen lässt, wird dieser nahezu immer fest – er kristallisiert aus und wird dabei hart. Die Viskosität oder Zähigkeit des Honigs hat seine Grundlage ebenfalls in den zwischenmolekularen Wechselwirkungen, die sich zwischen den Zuckermolekülen, die sich im Honig befinden, ausbilden. Bei niedrigen Temperaturen können sich die Wasserstoffbrücken zwischen den Hydroxygruppen der Zucker-Moleküle gut ausbilden. Dadurch wird der Honig besonders zäh. Die Zuckermoleküle lassen sich dabei nur schwer voneinander lösen und in Bewegung setzen. Erhitzt man Honig dagegen, so wird dieser aufgrund der gesteigerten Molekülbewegung und dem damit verbundenen Lösen der Wasserstoffbrücken wieder flüssig. Wenn der Honig zu zäh ist, kann er also schnell und problemlos im Wasserbad erwärmt werden und dabei wieder zum Fließen gebracht werden.