Wenn du schon einmal ein Fenster geputzt hast, hast du sicher darauf geachtet, dass das Fenster möglichst streifenfrei und ohne Rückstände sauber ist (Abb. 1). Wenn du das Fenster mit Wasser putzt, musst du mit dem trockenen Lappen oft drüber wischen, bis das Fenster trocken ist. Verwendest du einen speziellen Fensterreiniger, verfliegt die Flüssigkeit auf der Scheibe viel schneller als bei Wasser. Wir sagen dazu, dass es Flüssigkeiten gibt, die schneller verdunsten als Wasser.
Den gleichen Effekt kannst du im direkten Vergleich von Wasser und Pentan beobachten. Pentan wird beispielsweise auch deshalb als Kühlmittel verwendet. In der Animation (Abb. 2) geben wir jeweils einen Tropfen des Wassers und des Pentans auf ein Uhrglas. Mit der Zeit verdunstet das Pentan schneller als das Wasser. Das liegt daran, dass Wasser-Moleküle Dipole sind und Pentan-Moleküle keine Dipole bilden. Dadurch sind auch die zwischenmolekularen Wechselwirkungen unterschiedlich stark.
Wie genau die zwischenmolekularen Wechselwirkungen funktionieren und welche Auswirkungen sie auf die Eigenschaften von Flüssigkeiten haben, erklären wir dir in diesem Artikel.
Abb. 2 Vergleich: Verdunstung von Wasser und Pentan
Dipol-Dipol Wechselwirkungen haben Auswirkungen auf Stoffeigenschaften
Stelle dir den Aufbau eines Wasser-Moleküls vor. Wir haben drei Atome, die miteinander verbunden sind. Jedes Atom hat einen positiv geladenen Kern mit negativ geladenen Elektronen drum herum. In dem Wasser-Molekül sind die Wasserstoff-Atome mit dem Sauerstoff-Atom durch Elektronenpaare miteinander verbunden. Insgesamt gilt diese Verbindung als neutral.
Müssten sich nicht alle Wasser-Moleküle sich ähnlich wie Billard-Kugeln beim Zusammenstößen immer wieder voneinander entfernen, weil sie außen um die positiven Atomkerne die negativen Elektronen sitzen haben? Dann müsste Wasser immer gasförmig vorkommen, weil die Wasser-Moleküle sich nicht aneinander halten könnten. Tatsächlich ist es aber ganz anders, denn wir alle kennen flüssiges Wasser. Das ist ganz normal für uns.
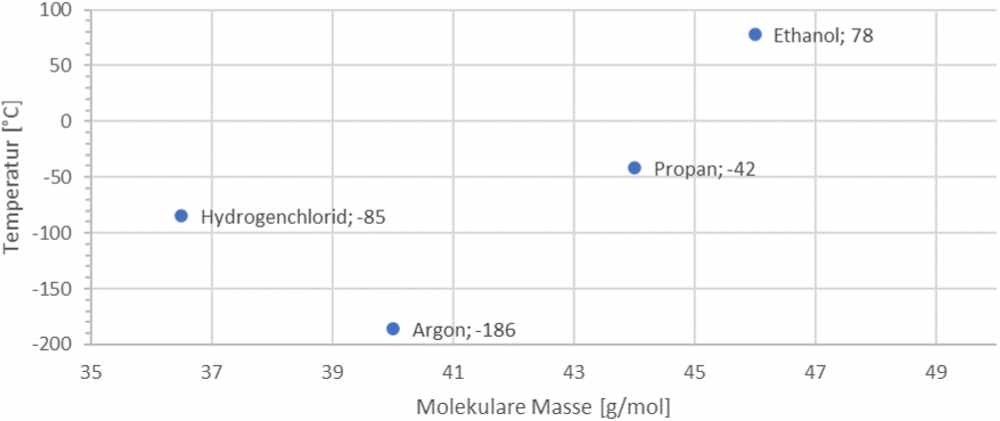
Bei welcher Temperatur ein Stoff von flüssig zu gasförmig wird, hängt von den zwischenmolekularen Wechselwirkungen und der Masse der Moleküle ab.
Vor allem bei der Änderung des Aggregatzustandes, wie z. B. dem Sieden, werden die Unterschiede zum Einfluss der Masse sehr gut sichtbar. Hydrogenchlorid-Moleküle sind zwar in dem Vergleich der vier Moleküle am leichtesten. Von den vier Stoffen hat Hydrogenchlorid aber nicht die niedrigste Siedetemperatur (Abb. 3). Obwohl Propan-Moleküle schwerer sind, besitzt der Stoff Propan eine ähnliche Siedetemperatur wie der Stoff Hydrogenchlorid.
Dipole entstehen durch unterschiedlich starke Anziehungen der Elektronen
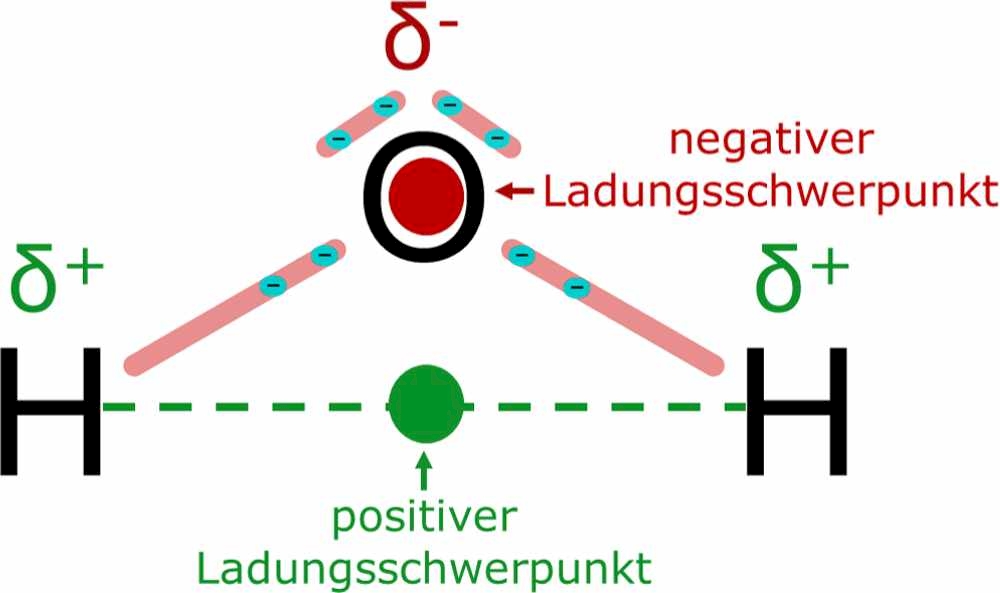
Ein Dipol entsteht aufgrund einer dauerhaften Verschiebung der Ladungsschwerpunkte innerhalb eines Moleküls (Abb. 4). Grund für die Verschiebung der Ladungsschwerpunkte sind die unterschiedlichen Anziehungs- und Abstoßungskräfte zwischen Kern und Hülle innerhalb eines Moleküls. Einen Wert zur Messung der Elektronen-Anziehungskräfte des Kerns stellt die Elektronegativität dar. Je höher die Elektronegativität ist, desto stärker fallen die Elektronen-Verschiebungen innerhalb eines Moleküls aus und führen damit zu einer einseitigen Verteilung der negativen Ladung. Dadurch entstehen eine positive und eine negative Teilladung (Partialladung).
Ein Dipol hat Elektronenpaarbindungen mit einer Elektronegativitätsdifferenz von 0,5 bis 1,7. Die Differenz der Elektronegativität von dem Sauerstoff-Atom und dem Wasserstoff-Atom im Wasser-Molekül beträgt 3,44 - 2,2 = 1,24. Damit ist das Wasser-Molekül ein starker Dipol.
Dipol-Dipol Wechelwirkungen herrschen zwischen Molekülen, die Dipole sind
Dipol-Dipol-Wechselwirkungen sind starke zwischenmolekularen Wechselwirkungen. Bei einer Dipol-Dipol-Wechselwirkung interagieren mindestens zwei Moleküle miteinander, die jeweils einen permanenten Dipol bilden.
Dipolmoleküle treten miteinander in Wechselwirkung, sobald sie sich nahekommen. Die Stärke dieser Dipol-Dipol-Wechselwirkungen hängt dabei von der Entfernung und der relativen Orientierung der Teilladungen innerhalb eines Moleküls ab. Gibt es starke Unterschiede in der Ladungsverteilung eines Moleküls, führt das zu stärkeren Anziehungskräften zwischen zwei gleichartigen Molekülen. Außerdem gilt: Je geringer der Abstand zwischen zwei benachbarten Molekülen ist, desto stärker sind die dort auftretenden Dipol-Dipol Wechselwirkungen. Das hat großen Einfluss auf die physikalischen Eigenschaften von Stoffen, wie zum Beispiel den Schmelz- und vor allem den Siedepunkt.
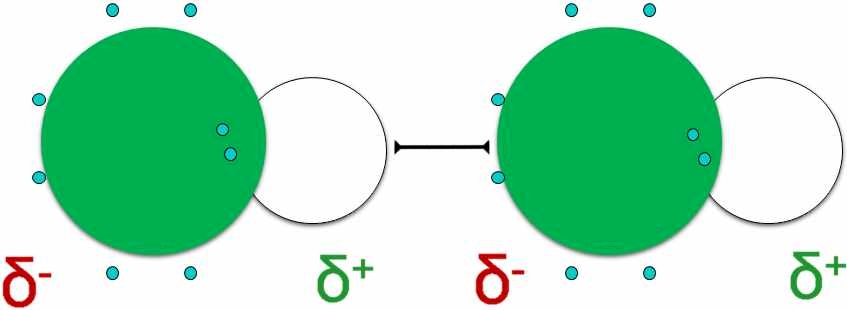
Ein Beispiel für die Ausbildung von Dipol-Dipol-Wechselwirkungen sind die Hydrogenchlorid-Moleküle (Salzsäure, HCl) (Abb. 5). Die Differenz der Elektronegativität der kovalent gebundenen Atome Wasserstoff und Chlor liegt bei 0,96. Das bedeutet, dass der Kern des Chloratoms Bindungselektronen stärker anziehen kann als das beim Wasserstoff der Fall ist. Die Ladungsschwerpunkte verlagern sich aufgrund der Ausbildung eines positiven und eines negativen Pols, wie in der zweiten Abbildung gezeigt.
Deshalb ziehen sich das Chloratom (mit negativer Partialladung) des einen Moleküls und das Wasserstoffatom (mit positiver Partialladung) des anderen Moleküls an, wodurch die angesprochene Wechselwirkung ausgebildet wird.
Die Dipol-Dipol-Wechselwirkungen sind bei kleinen Molekülen stärker als die London-Dispersions Wechselwirkungen, jedoch schwächer als die Wasserstoffbrücken.